date:2025-02-28 13:17:51
本应用阐述了使用 µ-Slide I Luer 0.8 通道载玻片(ibidi,货号80196)在静态条件下培养细菌生物膜,并通过共聚焦激光扫描显微镜(CLSM)与扫描电子显微镜镜(SEM)联合成像的实验方案。

将铜绿假单胞菌 Pseudomonas aeruginosa DSM 50071T 接种到 µ-Slide I Luer 0.8 通道载玻片中,培养3天。为促进细胞贴壁及表面生物膜的形成,在培养约36小时后更换培养基,以去除游离细胞。为确认生物膜的形成,在生长培养基中添加了无毒光学示踪剂EbbaBiolight 680,该试剂适用于活细胞成像,它与细胞外基质中的蛋白质及多糖结合时会发出红色荧光,从而可作为细菌生物膜的可视化标记。
基于用DAPI进行DNA染色并用共聚焦激光扫描显微镜(CLSM)成像的结果,细菌细胞附着并主要形成单层或双层结构。通过光学示踪剂发出的荧光信号增强,可以识别出更厚的生物膜结构。本实验旨在在同一张载玻片上结合多种成像技术。因此,在CLSM成像后,将细胞固定在同一张载玻片上,进行脱水处理,然后干燥,以便用于扫描电子显微镜(SEM)成像。实验室自制了一个3D模具,用于分离盖玻片,确保在操作过程中不破坏贴壁细胞的空间结构。随后,在分离出的盖玻片上,对形成的细菌细胞层进行2000倍至15000倍的放大成像。
1、材料与试剂
•铜绿假单胞菌培养物 Pseudomonas aeruginosa culture(DSMZ,50071)
•胰蛋白酶胨(Thermo Fisher Scientific,211705)
•大豆蛋白胨(Millipore,1.07212)
•葡萄糖(VWR,24379)
•氯化钠(NaCl,VWR,27800)
•磷酸氢二钾(K2HPO4, Sigma, P3786)
•磷酸盐缓冲液(PBS,Sigma,P7994)
•EbbaBiolight 680(EbbaBiotech AB)
•4',6-Diamidino-2-Phenylindole (DAPI, stock conc. 1 mg/mL, Thermo Fisher Scientific, 62248)
•25%戊二醛(Sigma,G7776)
•去离子水(diH2O)
•无水乙醇(Sigma,34852-M)
1.2 缓冲液与溶液
培养基
•Tryptic soy broth (TSB; 17 g/L tryptone, 3 g/L peptone from soymeal, 2.5 g/L glucose,5 g/L NaCl and 2.5 g/L K2HPO4)
•TSB supplemented with 1:1000 EbbaBiolight 680
洗涤缓冲液
•1xPBS
染液
•1:1000 DAPI in 1x PBS (最终浓度为1 µg/mL)
30%、50%、70%、90%、100% (v/v)无水乙醇稀释液
•混合适当体积的去离子水和无水乙醇制得。
1.3 仪器与设备
•µ-Slide I Luer 0.8 通道载玻片,ibiTreat组织处理(ibidi,80196)
•层流柜
•通风橱
•30°C恒温培养箱
•55°C恒温培养箱
•移液器
•冰箱
•干燥器
•手术刀或刀片
•剪刀
•镊子
•切割模具(如图1所示)
•倒置共聚焦显微镜(此处指:ZEISS LSM 880)
•ZEN black 2.3 SP1
•(Fiji Is Just) ImageJ 1.54f
•扫描电子显微镜(JEOL JSM-6480LV)
•金镀膜(此处指:JEOL JFC-1200 精细镀膜机)
•碳胶带
•JEOL JSM-6480 version 7.07

图1:切割模具示意图—白色线条表示切割位置,沿着 µ-Slide I Luer 0.8 载玻片(底部)与储液池外边侧(顶部)
2、实验步骤
2.1 细菌生物膜附着
操作µ-Slide I Luer 0.8 前请阅读说明书,并遵循µ-Slide通用移液及液体更换建议。所有步骤需在无菌条件下进行。
实验开始前,将铜绿假单胞菌(Pseudomonas aeruginosa DSM 50071)接种于LB培养基(如100 mL锥形瓶),30°C、160转/分钟避光振荡培养过夜。按供应商说明,将培养物以1:100比例稀释于含1:1000光学示踪剂(optotracer)的培养基中(注:细胞浓度未调整至供应商推荐的值)。
关键提示:需将所需材料(如µ-Slide)置于30°C培养箱中平衡过夜。平衡处理可确保材料温度与环境一致,从而避免后续操作中因温差导致气泡形成。
1.根据说明书,将200 µL稀释菌液注入µ-Slide I Luer 0.8 通道载玻片,并用随附的盖子密封载玻片。
2.室温(RT)避光静置2小时,使细胞沉降并附着。
3.向每个储液池加入60 µL含光学示踪剂的TSB培养基,并用盖子封闭两侧储液池。
4.将µ-Slide于30°C避光静置培养1-2天。
5.按说明书从一侧储液池吸取100 µL液体,并加入100 µL新鲜配制的含光学示踪剂TSB培养基,完成培养基更换。
6.重复上一步骤5-10次,确保培养基完全替换,避免气泡产生。
7.向µ-Slide储液池注入60 µL无细胞补充TSB培养基。
8.再次将µ-Slide置于30°C避光静态条件下孵育1至2天,促进进一步贴壁及生物膜形成。
2.2 DAPI染色及共聚焦激光扫描显微镜(CLSM)观察
染色直接在µ-Slide I Luer 0.8 中进行,所有步骤需在通风橱内完成。
关键提示:避免一次性移除通道内全部液体,防止细胞干燥。
1.置换为1×PBS缓冲液:从一侧储液池移除100 µL培养基,向另一侧加入100 µL 1×PBS冲洗液。
2.重复步骤1(5-10次),直至培养基完全被1×PBS替代。
3.DAPI染色:按上述移液技术,将1×PBS替换为DAPI染色液,确保通道完全充满。
4.室温避光静置孵育 µ-Slide10分钟。
5.按照之前的移液技术,使用去离子水(diH2O)冲洗两次,去除多余染料。
6.按照之前的移液技术,最后用1×PBS冲洗一次。
7.成像:使用共聚焦激光扫描显微镜(CLSM)拍摄附着细胞(图2)。
8.将µ-Slide于4°C冷藏保存(未固定样品最长2天),以待后续处理。

图2:共聚焦显微镜下染色的铜绿微囊藻生物膜(红色:EbbaBiolight680(Cy3.5),蓝色:DAPI)。63x物镜。细胞大多呈单层附着。一些类似于生物膜的三维结构清晰可见,尤其是在红色信号较强的部分,突出显示了光学示踪剂与生物膜成分的结合。
2.3 SEM 样品制备
样品制备直接在µ-Slide I Luer 0.8 中进行,所有步骤需在通风橱内完成。
关键提示:请勿一次性移除通道内的全部液体,避免细胞干燥。所有清洗与溶液更换步骤均按说明书要求执行:从一侧储液池移除100微升溶液1,并向对侧储液池加入100微升溶液2。重复此操作直至溶液完全替换。
1.固定:按2.2节步骤1的移液技术,将通道及储液池内1×PBS替换为含2.5%戊二醛的1×PBS溶液,以固定贴壁细胞
2.室温孵育载玻片3-4小时(或4°C过夜)。
3.用1×PBS冲洗至少5次,彻底去除戊二醛。
4.梯度脱水:依次用30%、50%、70%、90%无水乙醇孵育15分钟/次,使附着的生物膜脱水。
5.完全脱水:100%乙醇处理两次,每次20分钟。
6.干燥:将通道载玻片置于55°C培养箱中干燥,不要盖上盖子,直至液体完全蒸发(本实验干燥2小时)。
7.将µ-Slide保存于干燥器中以待后续处理。
8.样品切割:按示意图(图3)用手术刀或刀片切割载玻片。
9.切割后的载玻片竖直存放于干燥器内(可保存数周)。
10.镀金:将载玻片切割为≈1 cm小段,镀金两次(图4)后用于电镜观察。
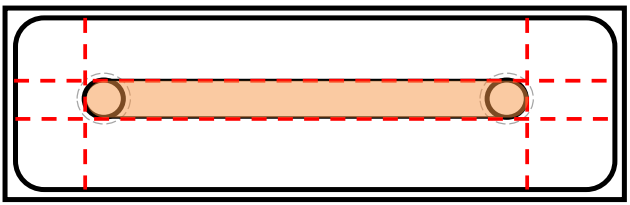
图3:µ-Slide I Luer 0.8 载玻片切割示意图。红色虚线为切割线,彩色区域为可移除的盖玻片部分。

图4:附着于µ-Slide I Luer 0.8 载玻片的铜绿假单胞菌(Pseudomonas aeruginosa)细胞及生物膜的扫描电镜成像。(A)2000倍与(B)7500倍放大图像。
ICP备案号:
沪ICP备15057650号-1
 沪公网安备31011202005471
沪公网安备31011202005471
雷萌生物科技(上海)有限公司 保留所有版权.