date:2024-12-06 09:46:29
导言:动脉粥样硬化是一种影响全球数百万人的慢性疾病,可导致心脏病发作、中风和其他心血管并发症。这种疾病的核心是斑块在动脉壁内逐渐堆积,导致血流受限、炎症,最终引发心脏病发作等危急事件。动脉粥样硬化发生的一个关键因素是剪应力,即血流对动脉壁施加的机械力。在层流血流区域,内皮细胞的功能趋于正常。与此相反,内皮细胞功能障碍发生在血流紊乱或振荡的区域--通常在动脉分叉处,因此这些区域容易形成斑块。[1]
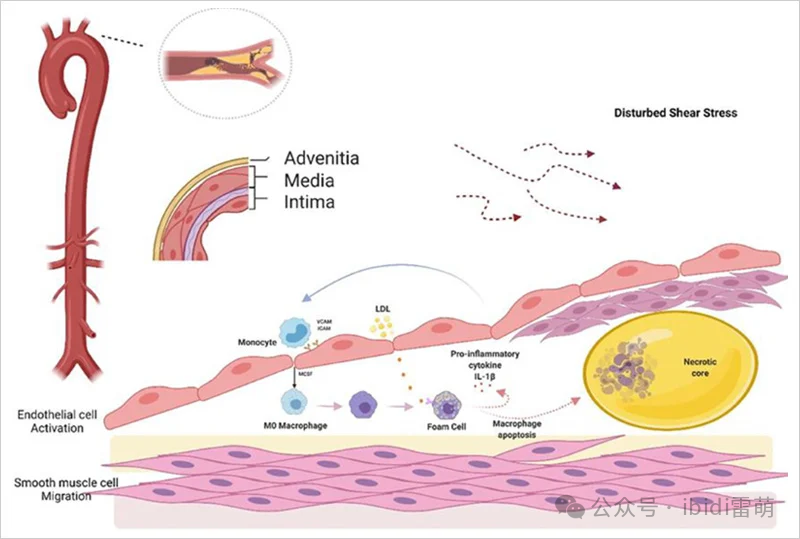
该图来源:CC BY 4.0 from Hua Y et al., Front. Cardiovasc. Med. 2022;9:831847.
动脉粥样硬化的发病机制
剪切应力通过激活内膜层的内皮细胞引发动脉粥样硬化。这些细胞通常具有保护作用,但在剪切应力的干扰下会变得易渗透,从而允许单核细胞和低密度脂蛋白进入。氧化的低密度脂蛋白形成泡沫细胞,释放促炎因子,通过ICAM和VCAM吸引更多的单核细胞,形成反馈循环。 这最终导致坏死核心被平滑肌细胞覆盖,形成纤维帽。
传统的研究模型,如动物实验和静态细胞培养,在复制人体血管生理的复杂动态方面存在局限性。动物模型往往无法准确模拟人体条件,而静态培养则缺乏剪切应力等基本机械力。这些局限性阻碍了人们全面了解内皮细胞在真实生理环境中的行为方式,因此需要更先进的体外系统。微流控灌流系统通过重现模拟疾病进展所需的生理条件,解决了这些难题。在本篇文章中,我们将探讨这些系统如何帮助研究人员更有效地研究动脉粥样硬化并开辟新的治疗途径。
微流控:动脉粥样硬化研究的新前沿
微流体灌注系统已成为传统研究模型的有力替代品。通过使用模仿血管结构的小通道,微流控系统可在动态流动条件下长期培养血管内皮细胞和上皮细胞,使其成为研究动脉粥样硬化的理想选择。[2]
例如,ibidi Pump System泵系统/流体剪切力系统就是专为在生理相关条件下进行流动检测而设计的。该系统使研究人员能够对培养细胞施加可控水平的剪切应力,模拟细胞在体内所受的力。通过调整流速和模式,科学家可以重现循环系统不同区域的各种血液动力学环境。

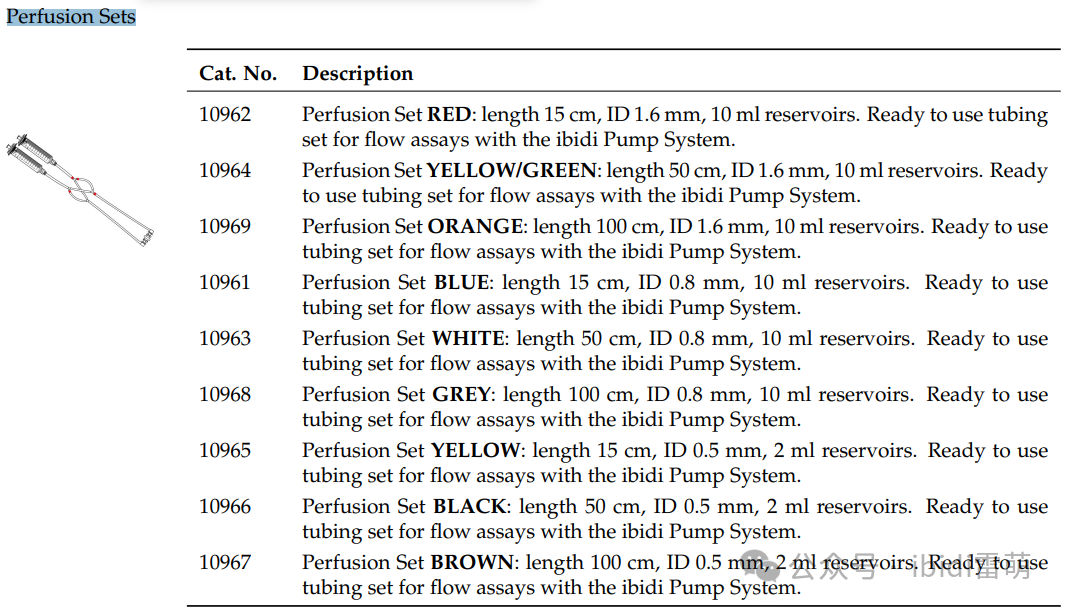
适合您应用的最佳灌注套装和载玻片
ibidi提供多种不同体积和几何形状的Channel Slides通道载玻片,可与具有不同管长和内径的Perfusion Sets 灌注套装搭配使用。使用ibidi泵系统,灌注套装和通道载玻片的每种组合都能达到特定的剪切应力范围。可根据《Perfusion Sets灌注套装置和Channel Slides通道载玻片选择指南》,来选择符合您所需剪切应力的最佳组合。
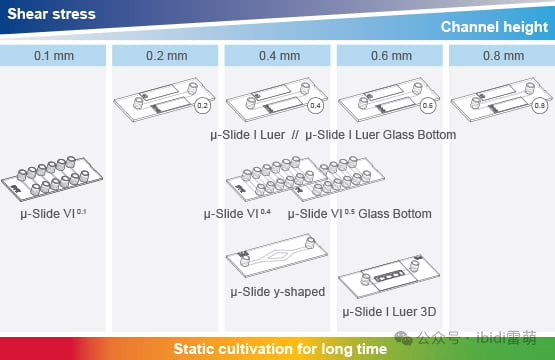
这些系统的一个主要优势是能够复制健康和病理流动条件。 在健康血管中,暴露在层流剪切应力下的内皮细胞能保持抗炎特性,防止斑块形成。然而,在分叉等流动紊乱的区域,内皮细胞会受到低剪切应力或振荡剪切应力的影响,从而导致功能障碍、炎症和早期斑块的形成[3]。通过模拟这些条件,微流控灌注系统为研究动脉粥样硬化进展背后的细胞机制提供了一个强大的平台。
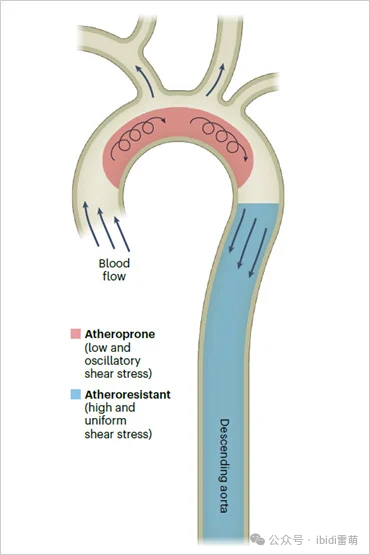
该图来源:CC BY 4.0 from Aitken C et al., Nat. Cardiovasc. Res. 2:517–529, 2023.
血管几何形状对血流动力学和内皮细胞健康的影响
在血管的直管段(如降主动脉),血流呈层状,可促进内皮细胞(EC)健康并抵御动脉粥样硬化。 与此相反,分叉或弯曲区域(如主动脉弓)的血流模式为低速和振荡型,这会导致内皮细胞发生病理变化,增加其对动脉粥样硬化的易感性。微流体灌注系统可以复制这些不同的血流条件,为了解血管功能障碍和疾病进展的内在机制提供帮助。
动脉粥样硬化微流控模型的关键检测指标
微流体灌注系统提供了研究动脉粥样硬化所必需的几种关键检测指标,使研究人员能够研究内皮细胞(EC)如何随着时间的推移对各种剪切应力条件做出反应。这些系统模拟了生理流动环境,可以实时观察细胞的行为和反应,以反映体内情况。
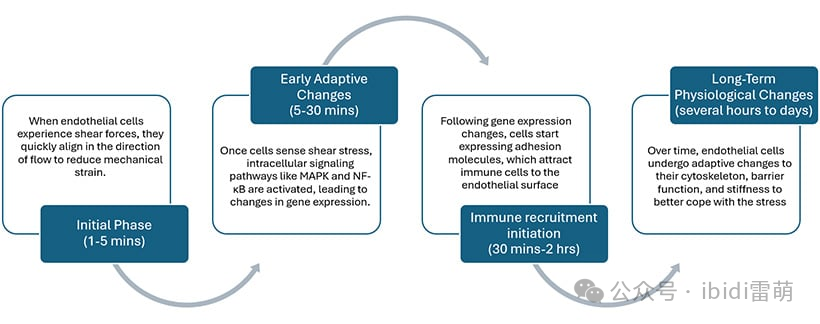
剪切应力引起内皮细胞随时间发生的细胞变化
细胞形态
在不同的流动条件下,内皮细胞会表现出不同的形态变化,这对血管健康至关重要。在层流区域,细胞与流动方向一致,呈细长形状。这种排列减少了机械应力,促进了最佳血流。与此相反,在振荡流动的情况下,细胞会失去排列方向,呈现出更不规则的形状。这种形态变化与功能障碍和炎症有关,会破坏正常的信号传递,并可能导致动脉粥样硬化等病症。
基因表达
流动条件会显著影响内皮细胞的基因表达。在不同的剪切应力下,内皮细胞可能上调炎症基因,包括细胞因子和粘附分子,同时还表达促进血管健康的基因,如参与一氧化氮产生的基因。[4]
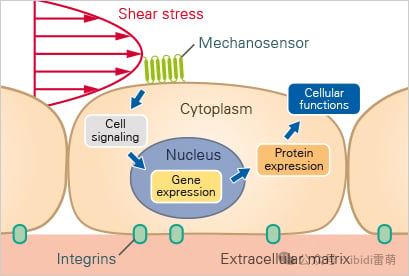
剪切应力诱导机械传导的下游效应
该图来源: CC BY 4.0 from Chien S., Am J Physiol Heart Circ Physiol. 2007;292
细胞粘附和炎症
动脉粥样硬化最早发生的事件之一是免疫细胞粘附到内皮层。 灌流系统使研究人员能够研究不同的流动环境如何影响ICAM-1和VCAM-1等粘附分子的表达以及免疫细胞的招募。这项研究有助于深入了解炎症导致斑块形成和血管疾病进展的机制。
细胞生理学
长期的生理适应包括细胞骨架重排、屏障功能增强和机械硬度增加,这有助于细胞应对持续的剪切应力。这些结构变化有助于提高细胞的完整性,从而影响动脉粥样硬化的进展。
在药物开发和治疗测试中的应用
通过模拟动脉粥样硬化的发展条件,这些系统为在受控环境中测试潜在疗法的疗效提供了一个平台。 例如,研究人员可以使用灌流系统测试不同的候选药物在真实的流动条件下如何影响内皮细胞功能、斑块形成和炎症[5]。这可以加快药物开发过程,及早了解治疗方法在体内的表现,减少动物试验的需要,提高临床试验成功的可能性。
此外,灌流系统还可用于研究他汀类药物或抗炎药物等现有疗法如何影响斑块的发展和消退。通过再现血流的机械力,研究人员可以更好地了解这些疗法如何在细胞水平发挥作用,从而开发出更有针对性和更有效的治疗方法。
病例研究:用ibidi Pump System泵系统模拟动脉粥样硬化
Chen B等人[6]所做的题为 "内皮大麻素CB1受体缺陷会降低动脉炎症和脂质摄取对动脉粥样硬化剪切应力的反应 "的研究探讨了大麻相关信号如何影响心血管健康,特别是内皮CB1受体(CNR1)在动脉粥样硬化中的作用。研究结果表明,动脉粥样硬化剪切应力会增加CNR1的表达,从而导致血管功能障碍、炎症和脂质吸收,加速动脉粥样硬化病变的形成。研究人员利用ibidi Pump System泵系统模拟了人主动脉内皮细胞(HAoECs)中的振荡剪切应力,发现这种应力会提高CNR1的表达。他们发现,内皮CB1缺乏与血管炎症和斑块堆积的减少有关,这表明靶向外周CB1受体可能是治疗动脉粥样硬化和代谢性疾病的一种有前途的策略,而不会产生中枢副作用。
总之,这些发现强调了内皮CB1在将剪切应力与动脉粥样硬化中的脂质代谢和炎症联系起来方面的重要性,突出了它是缓解疾病进展的潜在靶点。
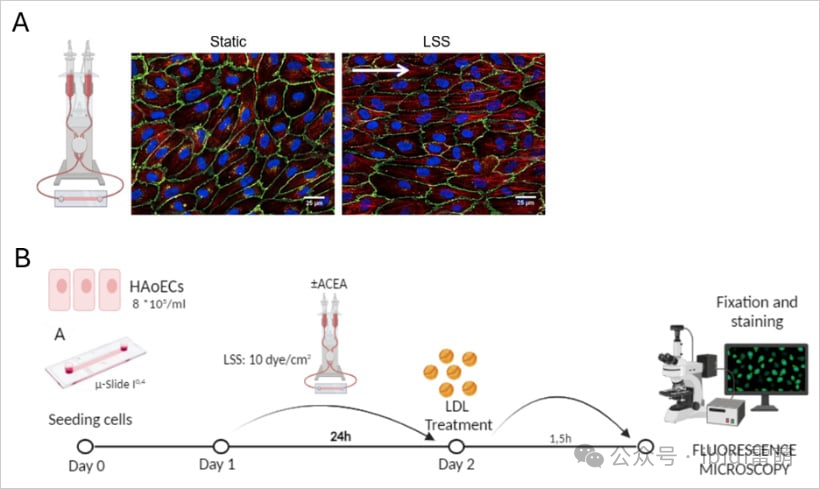
A:灌注室示意图和产生剪切应力的机制
静态和层流剪切应力(LSS)条件下人脐静脉内皮细胞(HUVEC)的代表性免疫荧光图像。
B:在HAoECs中进行LDL摄取实验的工作流程示意图
用ACEA(CB1激动剂)处理细胞,并在1.5小时的Dil-LDL孵育前暴露于LSS 24小时。采集图像以分析Dil-LDL摄取。
结论:动脉粥样硬化研究的未来
随着心血管研究的不断发展,微流控系统预计将在了解动脉粥样硬化的复杂性方面发挥至关重要的作用。这些系统可以精确控制实验条件,支持高通量分析,使研究人员能够同时研究多种细胞反应 [2,7]。将先进的成像技术与微流控技术相结合,进一步提高了实时观察细胞和分子事件的能力,使研究人员能够捕捉到内皮行为发生的微妙变化[8]。 此外,微流控平台可以定制,以包括患者衍生细胞,为考虑个体差异的个性化医学方法铺平了道路。这种精确性使我们有可能确定导致动脉粥样硬化的患者特异性因素,从而根据每个人的独特性量身定制治疗方案。未来,微流控技术与人工智能驱动的数据分析相结合,将加速新型药物靶点和生物标志物的识别,从而改变心血管疾病的诊断、治疗和管理方式。最终,微流控系统的不断发展有望加深人们对血管生物学的理解,推动心血管研究的发展,并在全球范围内改善患者的治疗效果。
参考文献
[1] Hua, Y., et al., The Induction of Endothelial Autophagy and Its Role in the Development of Atherosclerosis. Frontiers in Cardiovascular Medicine, 2022. 9.
[2] Zheng, H., et al., Microfluidic-based cardiovascular systems for advanced study of atherosclerosis. Journal of Materials Chemistry B, 2024. 12(30): p. 7225-7245.
[3] Aitken, C., et al., Mechanisms of endothelial flow sensing. Nat Cardiovasc Res, 2023. 2(6): p. 517-529.
[4] Chien, S., Mechanotransduction and endothelial cell homeostasis: the wisdom of the cell. American Journal of Physiology-Heart and Circulatory Physiology, 2007. 292(3): p. H1209-H1224.
[5] Lysyy, T., et al., Ex vivo isolated human vessel perfusion system for the design and assessment of nanomedicines targeted to the endothelium. Bioengineering & Translational Medicine, 2020. 5(2): p. e10154.
[6] Chen, B., et al., Endothelial cannabinoid CB1 receptor deficiency reduces arterial inflammation and lipid uptake in response to atheroprone shear stress. bioRxiv, 2024: p. 2024.05.15.594375.
[7] De Stefano, P., E. Bianchi, and G. Dubini, The impact of microfluidics in high-throughput drug-screening applications. Biomicrofluidics, 2022. 16(3).
[8] Maringanti, R., et al., Atherosclerosis on a Chip: A 3-Dimensional Microfluidic Model of Early Arterial Events in Human Plaques. Arteriosclerosis, Thrombosis, and Vascular Biology. 0(0).
ICP备案号:
沪ICP备15057650号-1
 沪公网安备31011202005471
沪公网安备31011202005471
雷萌生物科技(上海)有限公司 保留所有版权.