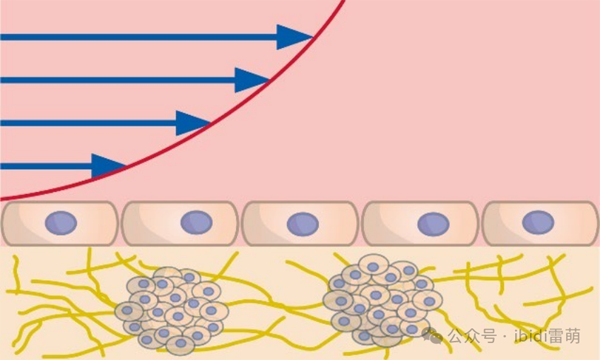
为了模拟肿瘤复杂的三维结构及其微环境,三维肿瘤球体模型已成为重要的体外模型系统。本实验方案详细阐述了使用ibidi µ-Slide I Luer 3D(货号:87176)将嵌入I型胶原的肿瘤球体与内皮细胞(HUVEC)共培养。该模型还可以通过灌流培养技术来模拟体内生理条件,尤其适用于研究肿瘤血管生成和转移。
灌流共培养示意图
ibidi为球状体和类器官灌注培养提供各种解决方案:
关键词:3D培养模型、肿瘤微环境、3D共培养;内皮细胞、肿瘤球状体、肿瘤血管生成
01、实验材料
重要提示:本方案针对MCF肿瘤细胞球状体和HUVEC细胞进行了优化;使用其他细胞球状体或内皮细胞时,请调整试剂和缓冲液。
1.1试剂和缓冲液
• 人脐静脉内皮细胞(HUVEC,12203,Promocell公司)
• Tumor-Spheroids肿瘤细胞球状体(此处使用MCF-7,CLS订单号:Cryovial 300273,Vital:330273)
• 内皮细胞生长培养基(ECGM,Promocell,C-22010)
• 内皮细胞生长培养基 2(ECGM 2,Promocell,C-22011)
• PBS (14190144, Gibco)
• Accutase细胞解离液(A1110501,Gibco)
• I胶原蛋白,大鼠尾,非胃蛋白酶化,5mg/ml(ibidi,50301),在17.5 mM乙酸中稀释至4mg/ml
• 10x RPMI 1640(Sigma,R1145)
• 1x RPMI 1640(Sigma,R8758)
• 培养基补充剂(如 L-谷氨酰胺,视细胞类型而定)
• 1 M 超纯水中的 NaOH
• 7.5%碳酸氢钠(Sigma,S8761)
• 无菌超纯水
1.2 设备与耗材
• µ-Slide I Luer 3D通道载玻片,ibiTreat 表面处理(货号:87176)
• ibidi pump system泵系统/流体剪切力系统(10902) 含一套灰色灌注管套装(货号:10968)
• 标准细胞培养设备(超净工作台、细胞解离试剂盒、培养瓶、移液器、吸头、培养皿等)
• 倒置显微镜
• 冰块和冷却架
重要提示:为避免产生气泡,灌注装置和培养基的脱气至关重要。在实验开始前一天将以下部件放入培养箱中。只要不打开包装,就能保持无菌状态。
• 灌注装置(在包装内)
• 用于细胞接种的细胞培养基(在小容器中加入所需体积的培养基,并稍微松开盖子)
由于气体在水和塑料中的溶解度与温度有关,因此有必要采用这一程序。在较高温度下,水和塑料吸收的气体比在较低温度下少。
02、制备含球状体的3D凝胶
在无菌条件下执行以下所有步骤。
1. 取出先前生成的球状体(例如,根据说明书使用µ-Slide Spheroid Perfusion球体灌注通道载玻片)并在室温下将其收集到层流罩下的试管中。
2. 如果凝胶基质中需要补充剂,可将其添加到1x细胞培养基中,并将其置于层流罩中的冰块上。
3. 将所有剩余成分和一个容量足以容纳总凝胶体积的无菌试管放在层流罩中的冰上
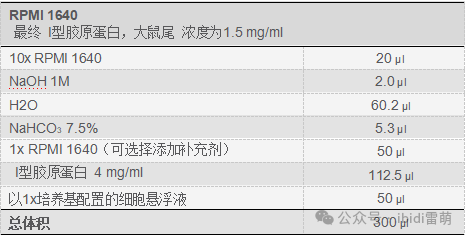
4. 用移液管将除胶原蛋白和细胞悬浮液外的所有成分按表1所列顺序移入试管中,并将其置于冰上。通过上下移液混合,然后放回冰上。
移取胶原凝胶的重要注意事项:
* 移取凝胶时一定要使用预冷移液器吸头(4°C)。
* 由于胶原蛋白I凝胶基质的粘度较高,建议在制备胶原蛋白I 胶基质的所有步骤中都采用反向移液法。将移液器按压至第二个压力点,将凝胶注入整个移液器吸头。仅在达到第一个压力点之前分配凝胶。这样移液器吸头中会有残留的凝胶需要丢弃,但体积会更加精确。另外,您也可以使用专为高粘度溶液设计的移液器。我们推荐使用Eppendorf Visco吸头或 Gilson Microman E吸头。
注意:即使在4°C温度下,凝胶混合物也最多可使用5分钟,然后会发生部分凝胶化。
5. 确保I型胶原蛋白大鼠尾在17.5 mM乙酸中稀释至4.0 mg/ml,请查看分析证书 (CoA) ,以了解批次特定的胶原蛋白浓度。
注意:在稀释胶原蛋白之前,必须用移液器上下移动几次,使其充分混合,以形成均匀的溶液。
6. 将胶原蛋白加入步骤5中制备的混合物中。用移液器充分混合,同时始终将试管置于冰上。
7. 将制备好的球状体悬液加入混合物中。尽量在50µl的体积中拾取更多的球状体。在最后一步中,通过短涡旋混合样品。
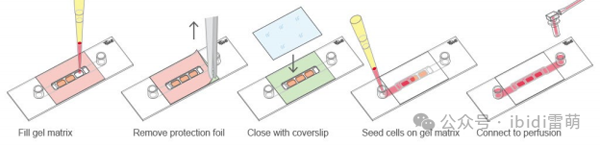
8. 现在可以将混合物移入 µ-Slide I Luer 3D中。移液过程中,请将载玻片放在冰上。
提示:为避免因冰而划伤,请将µ-Side放入培养皿中,然后将带有玻片的培养皿放在冰上。
使用µ-Slide I Luer 3D的实验流程示意图
9. 取下载玻片上侧的保护膜,然后在每个孔中加入16µl含有细胞球状体的胶原凝胶。注意避免产生气泡。
10. 然后,将盖玻片放在载玻片的粘性部分。按压盖玻片以确保粘合区域密封严实。
11. 用随附供的盖子盖住Luer鲁尔接头以保持无菌,然后将装有凝胶的载玻片放入细胞培养箱(37°C,5% CO2 )中培养45分钟,使其凝胶化。
12. 凝胶化后,使用10倍物镜的相差显微镜观察,可以看到胶原纤维。
表1.使用I型胶原蛋白和DMEM制备凝胶的移液方案,所有成分均按移液顺序排列
03、接种内皮细胞
在无菌条件下执行以下所有步骤。
1. 使用ibidi pump system泵系统/流体剪切力系统进行灌注时,如本文1实验材料所述,在实验前一天将灌流管套装和内皮生长培养基(ECGM和ECGM2)放入37°C的培养箱中预热。
2. 用Accutase处理HUVEC1-2分钟,使其脱离。
3. 收集细胞悬浮液,离心,用少量培养基(ECGM)稀释后进行计数。
4. 计数细胞,并将其调整至培养基中1.5×106 cells/ml的最终浓度。
5. 用生物兼容的1ml注射器将约 250µl细胞悬浮液注入通道。
6. 用标准移液器吸头移除Luer鲁尔接头中残留的细胞悬液,用随附的盖子盖住Luer鲁尔接头以保持无菌。
7. 将载玻片连同无菌湿巾放入培养皿中,然后其放入(37°C, 5% CO2)细胞培养箱中。
04、连接ibidi泵系统进行灌注
连接ibidi pump system泵系统/流体剪切力系统进行灌注
重要提示:内皮生长培养基2含有诱导细胞迁移和发芽的生长因子,如血管内皮生长因子和表皮生长因子。
1. 在细胞培养期间,按照ibidi Pump System中的说明准备ibidi Pump System。将ECGM2培养基注入储液池。
2. 孵育2小时后,将载玻片连接灌注系统,并注入ECGM2培养基。
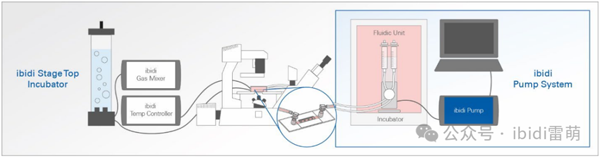
3. 如需进行延时系列成像,将载玻片放入显微镜载物台上的培养腔室(如ibidi Stage Top Incubator加热孵育系统)并开始延时成像。如需单帧成像,请提前设置好显微镜参数,以尽可能缩短成像时间。不成像时,将载玻片放回培养箱。若要进行终点分析,请在实验结束时固定细胞,然后继续染色(见本文「染色」章节)或执行下游方案。
灌注培养条件下的延时成像实验装置示意图
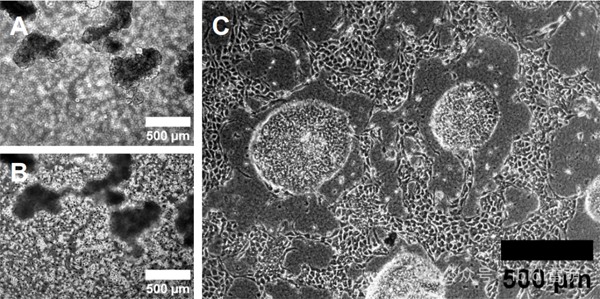
05、活细胞相差成像示例
相差镜检图像:在基质胶上生长的细胞球状体(A)与接种2小时后的HUVEC细胞(B)。(C) 在灌注条件下(流速约为0.5ml/min)共同培养3天后的球状体和HUVEC细胞。
06、染色
6.1 材料
• PBS (14190144, Gibco)
• 10%福尔马林,即用型(HT5011,Sigma Aldrich)
• Alexa Fluor 488标记的抗CD31抗体,MA5-18135 Invitrogen)
• Phalloidin-iFluor 647试剂(ab176758,Abcam )
• 4′,6-diamidino-2-phenyl-indole (DAPI)(D9542 Sigma Aldrich)
• Triton-X-100(A16046,Thermo Fisher Scientific)
• 破膜缓冲液(0.5% Triton X-100 加入 PBS)
• 封闭缓冲液(1% BSA + 0.2% Triton X-100 in PBS)
• 抗体稀释缓冲液(PBS 中含 1% BSA + 0.05% Triton X-100)
• 牛血清白蛋白(BSA)(A1470-10G,Sigma Aldrich)
6.2 染色步骤
1. 为实验制备充足的破膜缓冲液和封闭缓冲液。
2. 断开载玻片与泵之间的连接。
3. 用移液器从Luer鲁尔接头处吸出细胞培养液。
4. 在一个Luer鲁尔接头注入200µl PBS,轻轻清洗细胞两次,直到看到液体从另一个Luer鲁尔接头流出。
5. 用10%福尔马林替换PBS固定细胞。首先,从Luer鲁尔接头吸去PBS,然后向Luer接头处加入200µl福尔马林,让它流过载玻片的通道,然后从Luer鲁尔接头处吸去,再向Luer鲁尔接头中加入200µl福尔马林,并孵育细胞15分钟。
6. 吸去福尔马林,用100µl PBS冲洗细胞四次。
7. 将细胞放入200µl破膜缓冲液中孵育10分钟(与步骤5一样,用破膜缓冲液替换PBS)。
8. 去除破膜缓冲液,用200µl PBS冲洗细胞两次。
9. 用200µl封闭缓冲液封闭30分钟(与使用福尔马林时一样,用封闭缓冲液替换PBS)。
10. 在封闭期间,制备充足的抗体稀释缓冲液来稀释一抗和二抗。
11. 用抗体稀释缓冲液稀释标记抗体(或一抗)(1:100稀释度)。
12. 用200µl一抗溶液替换封闭缓冲液,然后在4°C孵育细胞过夜。
13. 在接下来的所有步骤中,应尽可能将样品置于暗处,以避免光漂白效应。
14. 用200µl封闭缓冲液清洗三次。
15. 在相同的抗体(Phalloidin 647 Conjugate 1:1000 稀释, DAPI 10 µg/ml)中稀释(第二抗体和)Phalloidiin和DAPI。
16. 用200µl的二次染色液替换封闭缓冲液,并在暗处孵育2小时。
17. 用200µl封闭缓冲液清洗三次。
18. 用PBS替换封闭缓冲液(每个通道200µl)
19. 将载玻片置于4°C黑暗处保存,直至镜检。理想情况下,应立即进行成像,因为存放时间过长会降低成像质量。
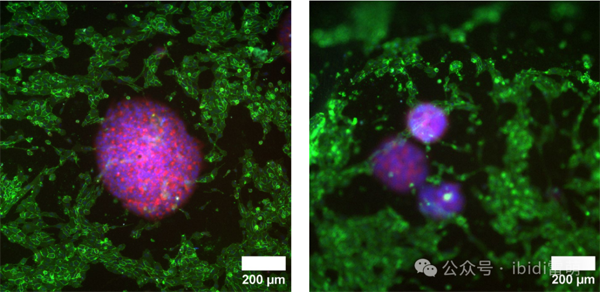
在灌注条件下共培养3天后,对球状体和HUVEC细胞进行染色;细胞核:DAPI(蓝色),肌动蛋白丝:Phalloidin iFluor 647(红色),CD31(HUVEC特异性标记):Alexa Fluor 488标记的抗CD31抗体(绿色)


 沪公网安备31011202005471
雷萌生物科技(上海)有限公司 保留所有版权.
沪公网安备31011202005471
雷萌生物科技(上海)有限公司 保留所有版权.