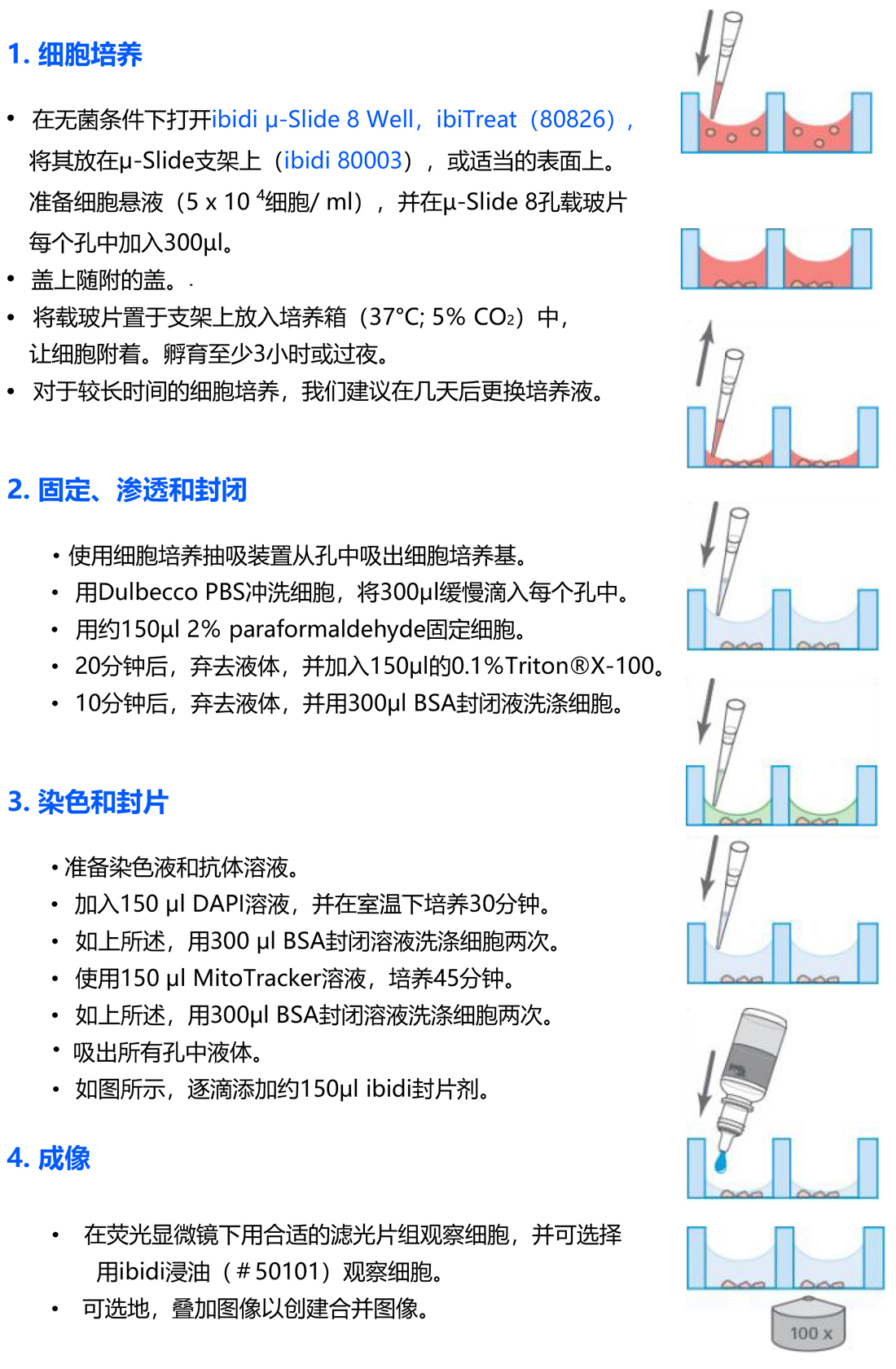
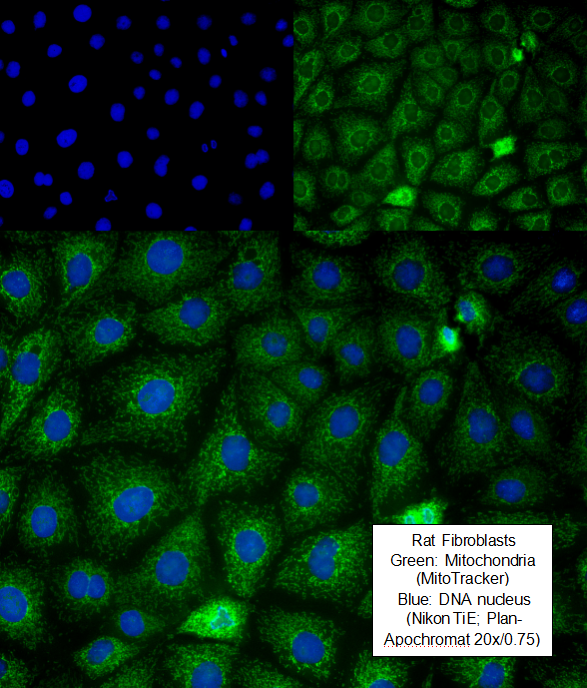
在本应用中,我们介绍了一个简单的方案,用于在ibidi的μ-Slide 8孔腔室载玻片中培养和染色贴壁细胞。在这个例子中,我们培养大鼠成纤维细胞,用多聚甲醛固定它们,用MitoTracker染色线粒体,并用DAPI复染细胞核。也可以使用所有常用的固定技术。此外,通过一抗和二抗染色,可以通过免疫细胞化学探测其他细胞内结构。
µ-Slide 8 Well
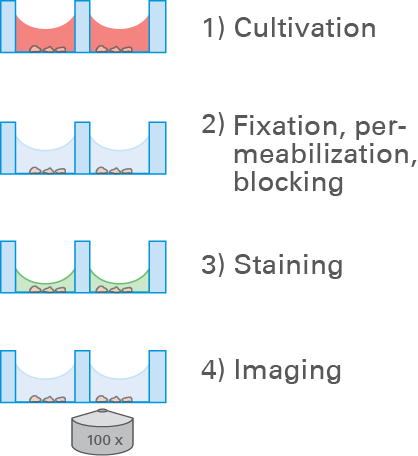
该实验包括四个主要步骤:
在本示例中,我们使用了以下材料:
• Rat fibroblasts (cell line) 大鼠成纤维细胞(细胞株)
• μ-Slide 8 well, ibiTreat (ibidi, 80826) 八孔腔室载玻片,ibiTreat底部
• Paraformaldehyde (2% in PBS) 多聚甲醛
• Triton® X-100 (Fluka, 0.1%)
• Blocking solution (1% BSA in PBS) 封片剂
• MitoTracker Green (Life Technologies, 50 nM) 线粒体绿色荧光探针
• DAPI (Sigma, 0.1 μg/ml)
• 荧光显微镜(倒置),带有适当的滤光片组
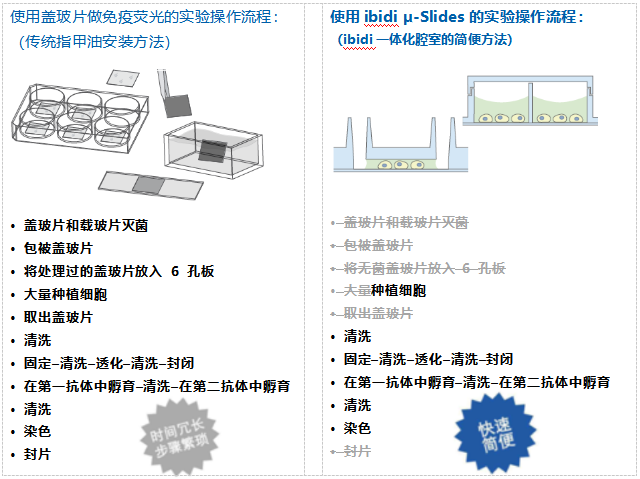
免疫荧光实验方案对比: 传统染色方案VS ibidi染色方案
使用任何一种ibidi免疫荧光染色方案比传统方案要简便、快捷的多,无需在盖玻片上培养细胞,细胞可直接在ibidi载玻片上培养和染色。
应用实例
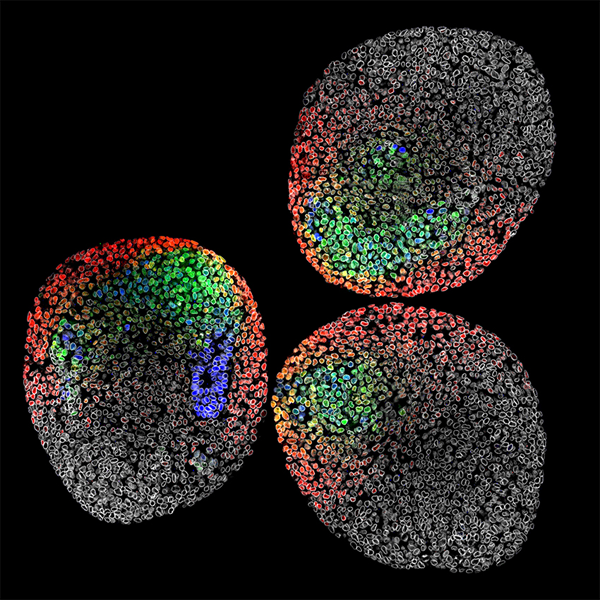
原肠胚是小鼠胚胎干细胞的3D聚集体,就在轴延伸之前。它们在 µ-Slide 8 孔上成像,并染色Sox2(蓝色)、Brachyury(绿色)、Tbx6(红色)和 LaminB1(灰色),突出显示了这些转录因子在神经中胚层祖细胞 (NMP) 中的空间排列和分化顺序。将原肠胚国定在BABB中,并使用Leica LIGHTNING系统在配备40倍油镜的Leica Sp8共聚焦显微镜上成像。图片来自英国爱丁堡爱丁堡大学的Matthew French。
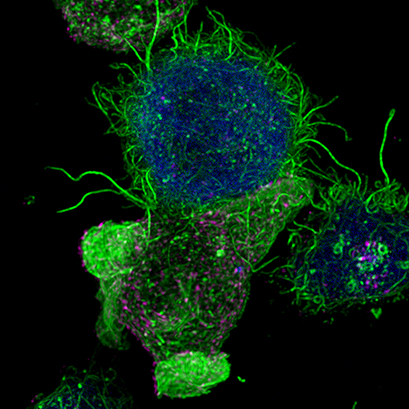
Jurkat T淋巴细胞(上)与抗原呈递细胞(下,蓝色)形成免疫突触的共聚焦图像。丝状肌动蛋白显示为绿色。多囊泡体显示为洋红色。细胞在 µ-Slide 8 孔上成像。图片来自西班牙马德里IIBM、CSIC的Manuel Izquierdo。
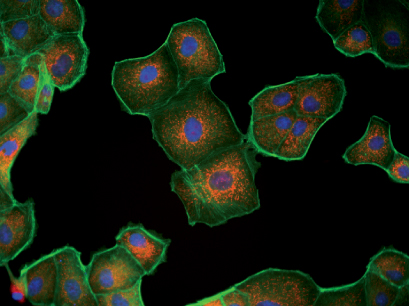
MDCK细胞的荧光显微镜法。线粒体(MitoTracker,红色),肌动蛋白细胞骨架(Phalloidin,绿色),细胞核(DAPI,蓝色)。
 沪公网安备31011202005471
雷萌生物科技(上海)有限公司 保留所有版权.
沪公网安备31011202005471
雷萌生物科技(上海)有限公司 保留所有版权.