date:2023-04-14 12:37:19
神经系统疾病是世界范围内的一个重大健康负担,近六分之一的人患有神经系统疾病。
这些疾病会影响整个神经系统,包括大脑、脊髓和周围神经系统 (PNS),通常会导致残疾或死亡。神经系统疾病可能由许多不同的因素引起,例如环境/营养影响、基因突变或外伤。示例是神经退行性疾病,如不同形式的痴呆(例如,阿尔茨海默氏症)、帕金森氏病和肌萎缩侧索硬化症 (ALS),还有中风、脑癌、传染病(例如,脑膜炎)和损伤。
神经科学研究的重点是研究中枢神经系统 (CNS) 和周围神经系统 (PNS) 的功能和组织,以了解神经过程并开发神经系统疾病和病症的生物标志物和疗法。
基于细胞的模型和检测在分子和细胞神经生物学中起着重要作用,因为它们允许研究受控条件下的神经细胞类型及其对各种刺激的反应。体外试验也可用于研究与疾病相关的神经功能变化的影响,以测试潜在的治疗方法。
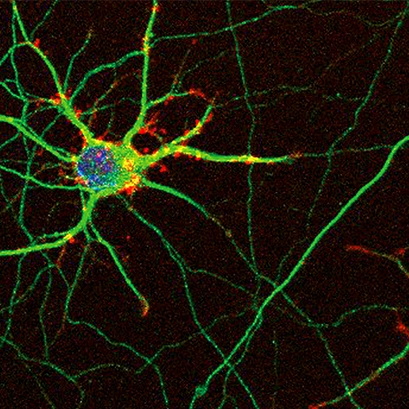
在 ibidi 细胞培养室上生长的小鼠海马神经元的共聚焦图像。对神经元进行 bIII-微管蛋白(绿色)、肌动蛋白纤维(红色)和细胞核(蓝色)的免疫染色。图片提供:意大利比萨高等师范学院 CNR 和 NEST 纳米科学研究所的 Ilaria Tonazzini
在本篇文章中,我们将介绍 5 种基于细胞的体外试验方法来研究神经系统状况和疾病,并为每种检测方法提供了应用示例。
01、荧光显微镜检测
免疫荧光和荧光原位杂交 (FISH) 等荧光显微镜检测用于使用荧光标签或探针可视化细胞或组织内的特定分子或结构。
在细胞和分子神经生物学中,免疫荧光检测(例如,免疫细胞化学、免疫组织化学和原位杂交)可用于获得对大脑和神经网络空间组织的重要见解。此外,标记蛋白质、DNA 和 RNA 可以可视化它们在这些网络中的功能角色,并可以揭示过程是否中断。免疫荧光是一种多功能、直接的方法,可以可视化细胞结构和成分的位置和相互作用。几乎每个细胞生物学实验室都可以轻松建立说明和工作流程。
多重荧光(同时对多种蛋白质进行染色)甚至可以同时显示不同的分子,这对于破译蛋白质的相互作用非常有用,例如,在神经信号过程中。
应用示例 1
免疫组织化学和荧光原位杂交 (FISH) 鉴定导致家族性 ALS 的突变
ALS 是一种慢性致命性神经退行性疾病,会导致运动神经元逐渐丧失。ALS 导致肌肉退化和虚弱加剧,最终导致丧失移动、说话、进食和呼吸的能力。
大多数 ALS 病例没有已知原因(散发性 ALS),而 5% 到 10% 的病例是遗传性的,可能与特定基因有关。在家族性 ALS 患者中发现了 FUS 基因的几种突变。
Gadgil et al.使用荧光原位杂交 (FISH) 和免疫荧光来鉴定 ALS 相关的 FUS 突变 (FUS P525L),该突变会破坏 U7 小核糖核蛋白 (U7 snRNP) 的定位。此外,他们还可以证明该突变体与 U7 snRNA 错误共定位到细胞质中并影响复制依赖性组蛋白基因(Gadgil 等人,2021 年)。
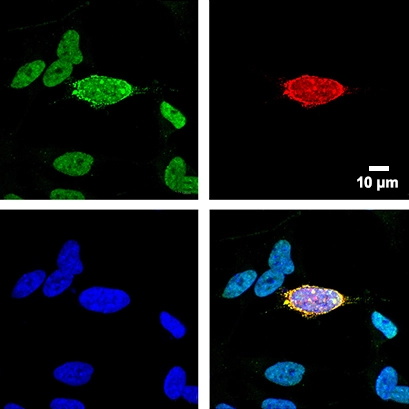
图 1 SHSY5Y FUS 敲除细胞转染含有 FUS 基因的质粒,FUS 基因带有 ALS 相关的 FUS P525L 突变。转染后 48 小时,对细胞进行 U7 snRNA 和 FUS 共染色。绿色:U7 snRNA 的 FISH 染色。红色:FUS P525L。蓝色:蓝色的细胞核 (DAPI)。在ibidi盖玻片底部培养室对细胞进行染色和成像。由波兰波兹南 Uniwersytetu Poznańskiego 先进技术中心 RNA 加工实验室的 Ankur Gadgil 友情提供。
02、活细胞成像
活细胞成像是一种强大的工具,可以实时可视化生理条件下的细胞过程。
阿尔茨海默氏症或多发性硬化症 (MS) 等神经退行性疾病的特征是大脑神经网络内的动态细胞过程发生变化。这些改变的过程会导致大脑中蛋白质运输和分类功能失调以及蛋白质聚集。神经迁移、趋化性和血管生成也是在神经健康和疾病中发挥重要作用的动态过程的示例(应用示例 2–5)。
活细胞成像允许在生理条件下实时跟踪这些动态过程 ( 见下方视频Mov. 1 )。
03、迁移和趋化性测定
细胞迁移和趋化性是神经系统的基本过程,在各种神经疾病的病理生理学中起着重要作用。例如,它们参与神经发育、受伤后的神经炎症以及脑癌的进展过程。
通过在活细胞成像期间跟踪单个细胞(应用示例 2)或通过将无细胞间隙引入细胞群并观察细胞覆盖区域的变化,可以在单细胞水平上研究细胞迁移动力学随着时间的推移,间隙闭合(应用示例 3,工作流程图 2)。
趋化性是细胞响应化学信号的定向运动。体外趋化性测定允许对细胞向特定分子的迁移进行定性和定量分析(应用示例 4,工作流程图 3)。
应用示例 2
迁移原代雪旺细胞的活细胞成像
雪旺细胞是 PNS 的神经胶质细胞。它们支持和保护神经元,在传递神经冲动以及神经发育和再生方面发挥着重要作用。因此,他们对再生医学非常感兴趣,以开发在神经损伤情况下增强雪旺细胞迁移潜能的疗法。Millesi et al.使用活细胞成像 (Mov. 1) 研究了初级雪旺细胞迁移。他们还探索了胶原蛋白纤维的再生作用,作为长距离周围神经缺陷的治疗选择(Millesi et al,2021 年)。
Mov. 1,雪旺细胞的活细胞成像,轨迹线跟随其迁移模式。细胞在μ-Slide 4 Well上培养,并使用 ibidi Stage Top 孵育系统成像。使用 Image J Manual Tracking plugin和Chemotaxis and Migration Tool进行细胞追踪和分析。友情提供:奥地利维也纳医科大学整形、重建和美容外科系的 F. Millesi。
应用实例 3
生长分化因子 11 (GDF11) 处理对轴突再生和细胞迁移的影响
创伤性脊髓损伤 (SCI) 可能是事故或疾病的结果。造成的伤害是不可逆转的,通常会导致运动功能丧失和瘫痪。
治疗干预的重点是抑制脊髓急性损伤后的神经退行性过程。Tsai et al.研究了 GDF11 是否影响脊髓损伤后的神经生成。他们在存在和不存在 GDF11 的情况下对脊髓神经胶质细胞培养物进行了伤口愈合实验(工作流程见图 2)。2 天后,他们观察到在 GDF11 存在的情况下细胞迁移和神经突延伸显着增强(Tsai et al,2022 年)。
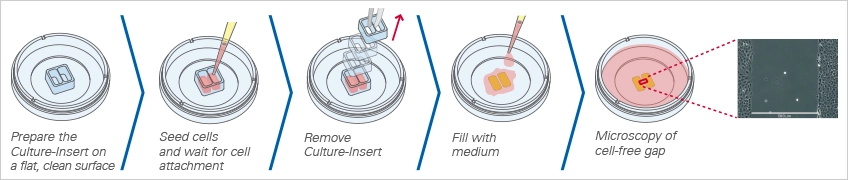
工作流程图 2 使用Culture-Insert 2 Well进行伤口愈合实验
应用示例 4
神经胶质瘤细胞对趋化因子 CC 配体 5 的趋化性测定
胶质母细胞瘤是一种生长迅速、侵袭性强的恶性脑肿瘤,预后较差(中位生存期为 1.5 年)。有多种治疗方法(手术、放疗、化疗),但由于残留的胶质母细胞瘤干细胞具有耐药性,肿瘤复发很常见。肿瘤微环境在其发展和进展中起着至关重要的作用。胶质瘤相关巨噬细胞 (GAM) 是浸润在肿瘤微环境中的免疫细胞,与促进肿瘤生长、血管生成和侵袭有关。GAM 已被证明是 CC 基序趋化因子配体 5 (CCL5) 的来源,CCL5 是一种丰富的趋化因子,在细胞免疫反应中发挥促炎作用。它在 GAM 中的表达通过触发细胞内钙信号传导和诱导基质金属蛋白酶 (MMP) 进一步促进肿瘤进展。
Yu-Ju Wu et al.建立 3D 趋化性测定(工作流程图 3)以研究存在和不存在粒细胞-巨噬细胞集落刺激因子 (GM-CSF) 的情况下胶质瘤细胞的趋化性侵袭,GM-CSF 存在于体内胶质瘤微环境中( Yu -Ju Wu et al.,2020)。
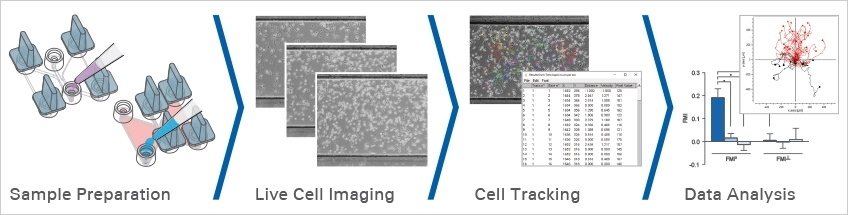
工作流程图 3 使用μ-Slide 细胞趋化载玻片进行趋化性实验
04、管形成分析
血管发育(血管生成)是神经健康和疾病的关键过程。血管生成需要一系列由缺氧引发的细胞事件。
管形成试验(工作流程图 4)是一种广泛建立的体外方法,用于研究血管生成和寻找促进或抑制血管生成的化合物。在神经退行性研究中,管形成分析可用于开发促进急性脑损伤后血管再生的疗法(应用示例 5),或表征抑制为脑肿瘤提供营养的血管形成的分子。
应用示例 5
Tube Formation Assay 研究脑外伤后血管再生
创伤性脑损伤 (TBI) 可以通过多种方式影响脑血管,导致血脑屏障 (BBB) 破坏、颅内压升高、脑血管痉挛和出血。这些影响会导致 TBI 后脑损伤和神经功能缺损的严重程度。FGF20是成纤维细胞生长因子家族的一员,已被证明具有神经保护作用,因此与帕金森病的治疗有关。
Guo et al.有兴趣了解FGF20是否对 TBI 后的脑血管系统也有保护作用。因此,他们使用管形成试验(工作流程图 4)来研究 FGF20 是否可以在体外促进永生化人脑微血管内皮细胞 (hCMEC/D3) 中的血管生成(Guo et al,2021 年)。

工作流程图 4 使用μ-Slide 15 Well 3D进行血管生成实验
05、流动条件下的细胞培养
流动条件下的细胞培养是一种体外方法,用于模拟血管/淋巴管的生理条件,并研究流体流动对内皮细胞产生的机械力(剪切应力)的影响。该技术已被用于包括神经科学在内的各个研究领域,以研究神经血管功能和神经病理学。
流动下的细胞培养使研究人员能够在受控环境中研究机械力对内皮脑血管细胞和 BBB 的影响。通过使内皮细胞 (EC) 经受流体流动,研究人员可以模拟 BBB 的生理条件,并深入了解其功能和功能障碍的潜在机制(应用示例 6)。
应用示例 6
hCMEC/D3细胞流体环境下培养
与所有 EC 一样,人脑微血管 EC 会受到血流产生的恒定机械力(剪切应力)的影响。与外周 EC 相比,剪切应力对 hCMEC 的细胞和分子效应知之甚少。
在最近的一项研究中,Choublier 等人。在生理层流下培养 hCMEC/D3 细胞以研究体外剪切应力的影响(工作流程图 5)。
他们使用 hCMEC/D3 细胞作为体外模型来研究 BBB,因为它显示了 BBB 的许多关键特性,包括紧密连接、转运蛋白和酶。他们可以表明,与沿流动方向排列的外周内皮细胞相比,hCMEC/D3 细胞垂直于流动方向排列。随后的蛋白质组学分析表明,层流生理剪切应力会诱导 hCMEC/D3 细胞静止,从而导致 EC 以及 BBB 的保护和抗炎作用(Choublier 等人,2022)。
工作流程图 5 使用 ibidi通道载玻片和ibidi泵系统进行流体环境下的细胞培养。
参考文献:
Ehrenberg AJ, Morales DO, Piergies AMH, Li SH, Tejedor JS, Mladinov M, Mulder J, Grinberg LT. A manual multiplex immunofluorescence method for investigating neurodegenerative diseases. J Neurosci Methods. 2020 Jun 1;339:108708. doi: 10.1016/j.jneumeth.2020.108708.
Gadgil A, Walczak A, St?pień A, Mechtersheimer J, Nishimura AL, Shaw CE, Ruepp MD, Raczyńska KD. ALS-linked FUS mutants affect the localization of U7 snRNP and replication-dependent histone gene expression in human cells. Sci Rep. 2021 Jun 4;11(1):11868. doi: 10.1038/s41598-021-91453-3.
Bakota L, Brandt R. Live-cell imaging in the study of neurodegeneration. Int Rev Cell Mol Biol. 2009;276:49-103. doi: 10.1016/S1937-6448(09)76002-2.
Millesi F, Weiss T, Mann A, Haertinger M, Semmler L, Supper P, Pils D, Naghilou A, Radtke C. Defining the regenerative effects of native spider silk fibers on primary Schwann cells, sensory neurons, and nerve-associated fibroblasts. FASEB J. 2021 Feb;35(2):e21196. doi: 10.1096/fj.202001447R.
Datta D, Subburaju S, Kaye S, Baruah J, Choi YK, Nian Y, Khalili JS, Chung S, Elkhal A, Vasudevan A. Human forebrain endothelial cell therapy for psychiatric disorders. Mol Psychiatry. 2021 Sep;26(9):4864-4883. doi: 10.1038/s41380-020-0839-9.
Tsai MJ, Fay LY, Liou DY, Chen Y, Chen YT, Lee MJ, Tu TH, Huang WC, Cheng H. Multifaceted Benefits of GDF11 Treatment in Spinal Cord Injury: In Vitro and In Vivo Studies. Int J Mol Sci. 2022 Dec 27;24(1):421. doi: 10.3390/ijms24010421.
Yu-Ju Wu C, Chen CH, Lin CY, Feng LY, Lin YC, Wei KC, Huang CY, Fang JY, Chen PY. CCL5 of glioma-associated microglia/macrophages regulates glioma migration and invasion via calcium-dependent matrix metalloproteinase 2. Neuro Oncol. 2020 Feb 20;22(2):253-266. doi: 10.1093/neuonc/noz189.
Codrici E, Popescu ID, Tanase C, Enciu AM. Friends with Benefits: Chemokines, Glioblastoma-Associated Microglia/Macrophages, and Tumor Microenvironment. Int J Mol Sci. 2022 Feb 24;23(5):2509. doi: 10.3390/ijms23052509.
Zhu H, Zhang Y, Zhong Y, Ye Y, Hu X, Gu L, Xiong X. Inflammation-Mediated Angiogenesis in Ischemic Stroke. Front Cell Neurosci. 2021 Apr 21;15:652647. doi: 10.3389/fncel.2021.652647.
Abou Khouzam R, Brodaczewska K, Filipiak A, Zeinelabdin NA, Buart S, Szczylik C, Kieda C, Chouaib S. Tumor Hypoxia Regulates Immune Escape/Invasion: Influence on Angiogenesis and Potential Impact of Hypoxic Biomarkers on Cancer Therapies. Front Immunol. 2021 Jan 20;11:613114. doi: 10.3389/fimmu.2020.613114.
Gi?o T, Saavedra J, Vieira JR, Pinto MT, Arsequell G, Cardoso I. Neuroprotection in early stages of Alzheimer's disease is promoted by transthyretin angiogenic properties. Alzheimers Res Ther. 2021 Aug 24;13(1):143. doi: 10.1186/s13195-021-00883-8.
Guo R, Wang X, Fang Y, Chen X, Chen K, Huang W, Chen J, Hu J, Liang F, Du J, Dordoe C, Tian X, Lin L. rhFGF20 promotes angiogenesis and vascular repair following traumatic brain injury by regulating Wnt/β-catenin pathway. Biomed Pharmacother. 2021 Nov;143:112200. doi: 10.1016/j.biopha.2021.112200
Choublier N, Taghi M, Menet MC, Le Gall M, Bruce J, Chafey P, Guillonneau F, Moreau A, Denizot C, Parmentier Y, Nakib S, Borderie D, Bouzinba-Segard H, Couraud PO, Bourdoulous S, Declèves X. Exposure of human cerebral microvascular endothelial cells hCMEC/D3 to laminar shear stress induces vascular protective responses. Fluids Barriers CNS. 2022 Jun 3;19(1):41. doi: 10.1186/s12987-022-00344-w.
ICP备案号:
沪ICP备15057650号-1
 沪公网安备31011202005471
沪公网安备31011202005471
雷萌生物科技(上海)有限公司 保留所有版权.