date:2022-03-21 17:17:51
实体瘤被包围并与由细胞外基质、成纤维细胞、免疫细胞、淋巴和血管内皮细胞以及其他基质细胞组成的肿瘤微环境(TME)相互作用。与经典的以肿瘤细胞为导向的基础研究相比,近几十年来,TME 越来越受到关注,为治疗方法开辟了新的前景(Balkwill et al., 2012)。
由于肿瘤过度生长以及血管连接和氧气供应不足,缺氧在癌细胞和 TME 中很常见。它可以以多种方式影响癌症生物学,促进血管生成,并与癌症进展和预后不良相关。因此,在处理癌细胞或基质细胞时,研究人员应考虑在缺氧条件下工作,因为它更准确地反映了肿瘤中的生理氧水平。使用ibidi Stage Top 培养箱,可以在活细胞成像实验期间在每个倒置标准显微镜上模拟低氧条件。

许多免疫细胞类型,例如 T 细胞和骨髓细胞(例如,肿瘤相关巨噬细胞,TAM),是 TME 的一部分,并且已经对其治疗适用性进行了深入研究。根据细胞亚型,它们可以具有促肿瘤或抗肿瘤活性,并与预后良好或不良有关。特别是 T 细胞具有以患者特异性方法破坏肿瘤细胞的潜力:具有工程嵌合抗原受体 (CAR T 细胞) 的 T 细胞已被开发用于过继性T细胞转移治疗,并在治疗 B细胞淋巴瘤。
在一个健康的系统中,免疫检查点会限制免疫反应以防止附带组织损伤。然而,在致瘤环境中,癌细胞可以控制这些检查点来抑制免疫系统对自身的破坏。通过过阻断免疫检查点(例如,通过抗 CTLA-4、抗 PD-1 或抗 PD-L1)对特定癌症类型(例如黑色素瘤)的免疫疗法的临床批准创造了一种全新的肿瘤治疗方法,这改善了成千上万患者的预后。然而,并非所有人都从免疫疗法中受益,有些人对治疗没有反应,而另一些人则获得了抵抗力。这些案例表明,仍需要更多的基础研究来评估更针对患者的治疗策略(Topalian et al., 2015; Waldman et al., 2020)。
有多种体外方法可用于破译肿瘤细胞与其微环境之间的通讯和相互作用机制:过继性T细胞转CAR-T 细胞杀伤试验、癌细胞和免疫细胞(或其他基质细胞)的共培养,以及滚动和粘附试验移,只是为了仅举几例,帮助世界各地的研究人员了解这一重要的癌症研究领域。
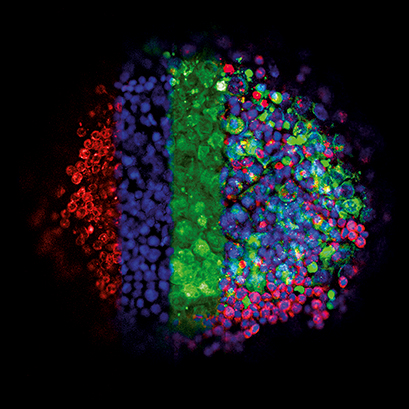
该图像显示了使用悬滴技术的生殖细胞肿瘤细胞(绿色,GFP)和免疫细胞(淋巴细胞,红色,mCherry)的三维生长。细胞核以蓝色 (DAPI) 显示。在 3D 培养中,不同细胞类型之间会形成密切的相互作用。将液滴转移到ibidi μ-Plate 96 Well中。使用具有 10 倍物镜的 Zeiss LSM 710 共聚焦显微镜获取图像。数据由德国杜塞尔多夫大学医院泌尿外科转化泌尿肿瘤科 Gillian Ludwig、Daniel Nettersheim 提供。
Balkwill, F. R., Capasso, M., & Hagemann, T. (2012). The tumor microenvironment at a glance. Journal of Cell Science. 10.1242/JCS.116392
Topalian, S. L., Drake, C. G., & Pardoll, D. M. (2015). Immune checkpoint blockade: a common denominator approach to cancer therapy. Cancer Cell. 10.1016/J.CCELL.2015.03.001
Waldman, A. D., Fritz, J. M., & Lenardo, M. J. (2020). A guide to cancer immunotherapy: from T cell basic science to clinical practice. Nature Reviews Immunology. 10.1038/s41577-020-0306-5
实验示例:CAR-T 细胞杀伤试验的自动分析
CAR-T细胞代表了一种有前途的新癌症治疗工具。活细胞成像允许以单细胞分辨率实时分析 T 细胞/癌细胞相互作用。然而,融合细胞层的分析非常耗时,因此在高通量筛选中是不可能的。为了促进活细胞成像装置中 T 细胞效力的高通量无标记分析,我们使用 ibidi 微图案技术生成了均匀分布的癌细胞阵列。通过结合光学分析和先进的图像处理,可以在不使用任何标记的情况下评估单个细胞水平上随时间推移的细胞毒性 T 细胞活性。
2D环境中的单个细胞模式(查看图片)
使用 RCC-26 肾肿瘤细胞和 JB4 T 细胞在单细胞模式上进行的 CAR-T 细胞杀伤试验的延时显微镜检查。MetaVi Labs 使用 FastTrack AI 分析数据。
3D 胶原蛋白基质中的多细胞聚集(查看图片)
固定在多细胞板上的 RCC-26 肾癌细胞。应用在 I 型胶原蛋白基质( I 型胶原蛋白,大鼠尾)中的效应 T 细胞诱导癌细胞的凋亡小体形成。
ibidi免疫肿瘤学和肿瘤微环境分析解决方案

ibidi µ-Slides 和 µ-Dishes包括不同的几何形状,它们结合了使用癌细胞、免疫细胞或其他基质细胞类型的功能性细胞分析的最佳条件。它们是免疫荧光、活细胞成像和高分辨率显微镜的理想选择。ibidi 实验室器具可与ibidi 聚合物盖玻片和ibidi 玻璃盖玻片一起使用。对于高通量实验,我们提供ibidi µ-Plates,可提供 24 孔或 96 孔

ibidi Stage Top 培养箱为每个标准倒置显微镜上的活细胞成像提供生理条件。它们包括CO 2和O 2控制(例如,用于缺氧实验)以及主动控制的湿度。它们可用于单个载玻片和培养皿以及多孔板。

µ-Slides with Single-Cell µ-Pattern是即用型微图案载玻片,具有适合单细胞分析的理想间距。具有µ-Slides With Multi-Cell µ-Pattern 可实现空间定义的细胞粘附,以生成球体和类器官。这两种解决方案都针对长期培养和高分辨率成像进行了优化,可用于多种癌细胞/免疫细胞相互作用研究(例如,CAR-T 细胞活性测定)等等。

ibidi泵系统非常适合在具有确定的剪切应力值的流动条件下进行长期细胞培养,并且与所有带 Luer 适配器的 µ- Slide 兼容。它模拟定义的连续和脉动层流和振荡流,以研究更生理环境中的细胞。它是滚动和粘附测定、迁移和入侵研究的最佳选择。此外,可以灌注细胞、球体和类器官以获得最佳营养。

ibidi 提供各种不同几何形状的通道载玻片。µ-Slide I Luer系列有一个通道,专为标准流动实验以及滚动和粘附试验而设计。µ-Slide VI有 6 个通道,非常适合平行流分析。两者都提供ibidi 聚合物盖玻片和ibidi 玻璃盖玻片,以及不同的高度和涂层
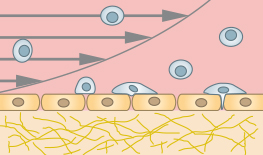
μ-Slide I Luer 3D无需人工滤膜即可创建内皮屏障。内皮细胞可以接种在合适的凝胶基质上,例如I 型胶原蛋白、大鼠尾。在将载玻片连接到泵并施加定义的剪切应力后,会创建一个类似体内的内皮屏障,这对于滚动和粘附分析或跨内皮迁移研究很有用。

µ-Slide 趋化性和粘性滑动趋化性非常适合在 2D 和 3D 中分析免疫细胞和癌细胞的单细胞迁移,因为它们可以快速创建稳定的趋化梯度。这些梯度很容易在 2D 或水3D 凝胶中建立,例如Collagen I凝胶和 Matrigel ®,因为凝胶结构不会阻碍通过扩散形成可溶性梯度。
参考文献:
Newton, H. S., Gawali, V. S., Chimote, A. A., Lehn, M. A., Palackdharry, S. M., Hinrichs, B. H., Jandarov, R., Hildeman, D., Janssen, E. M., Wise-Draper, T. M., & Conforti, L. (2020). PD1 blockade enhances K+ channel activity, Ca2+ signaling, and migratory ability in cytotoxic T lymphocytes of patients with head and neck cancer. Journal for Immunotherapy of Cancer. 10.1136/JITC-2020-000844
Sharma, V. P., Tang, B., Wang, Y., Duran, C. L., Karagiannis, G. S., Xue, E. A., Entenberg, D., Borriello, L., Coste, A., Eddy, R. J., Kim, G., Ye, X., Jones, J. G., Grunblatt, E., Agi, N., Roy, S., Bandyopadhyaya, G., Adler, E., Surve, C. R., … Oktay, M. H. (2021). Live tumor imaging shows macrophage induction and TMEM-mediated enrichment of cancer stem cells during metastatic dissemination. Nature Communications. 10.1038/s41467-021-27308-2
Luthria, G., Li, R., Wang, S., Prytyskach, M., Kohler, R. H., Lauffenburger, D. A., Mitchison, T. J., Weissleder, R., & Miller, M. A. (2020). In vivo microscopy reveals macrophage polarization locally promotes coherent microtubule dynamics in migrating cancer cells. Nature Communications. 10.1038/s41467-020-17147-y
ICP备案号:
沪ICP备15057650号-1
 沪公网安备31011202005471
沪公网安备31011202005471
雷萌生物科技(上海)有限公司 保留所有版权.