date:2021-09-09 11:26:35
#应用指南#
血管网络由哺乳动物生物体中的各种功能组成。血管将流体、气体、分子和细胞输送到身体的每个部位。此外,免疫细胞利用血管在全身巡逻,保护我们免受细菌、病毒和寄生虫的侵害。
血管形成是发育、健康和疾病过程中的关键过程。例如,在成人中,它发生在伤口愈合、骨骼生长、怀孕期间。血管生长失调通常与严重疾病有关,例如中风、心肌梗塞、动脉硬化和关节炎。此外,肿瘤血管化是癌症的标志之一。
# 血管新生和血管生成 #
管网络由两种不同的机制形成:血管新生和血管生成。
血管新生是血管的从头形成。中胚层前体细胞(成血管细胞)分化成内皮细胞,然后组装起来形成新的动脉和静脉。
血管生成是通过从现有血管发芽来扩展血管网络。
这一系列细胞事件包括细胞通过基底膜破裂、细胞迁移、细胞增殖和细胞间通讯。
这种严格调控的过程的驱动刺激之一是缺氧,它会诱导几种促血管生成基因的表达。因此,血管生成的抑制或激活提供了许多治疗机会。
例如,使用贝伐单抗阻断促血管生成血管内皮生长因子 (VEGF) 已被证明可以改善许多转移性结直肠癌 (mCRC) 和非小细胞肺癌 (NSCLC) 患者,尽管仍然存在一些耐药性。血管生成分析可以深入了解各种药物的促血管生成或抗血管生成潜力,从而有助于开发新的治疗方法。
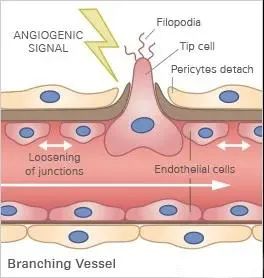
在血管生成期间,新血管从现有血管延伸。例如,内皮细胞突破基底膜并朝着由癌细胞、活化的巨噬细胞或淋巴细胞产生的血管生成刺激的方向迁移。在这个迁移前沿的背后,细胞增殖和重组以形成新的三维血管。
# 血管形成和分析 #
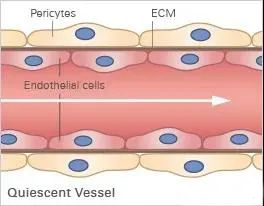
在我们的身体中,内皮细胞被基底膜包围,基底膜是一种薄且高度特化的细胞外基质 (ECM)。当内皮细胞,例如人脐静脉细胞 (HUVEC) 被接种到基底膜样表面(例如 Matrigel ®)上时,它们会在体外形成毛细血管样结构,从而重现血管生成。
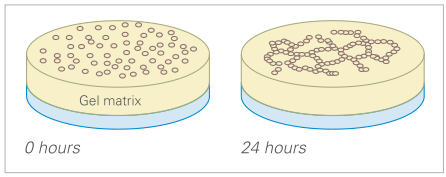
这种所谓的管形成试验已被广泛应用于解决各种实验问题,例如:
1.特定药物的促血管生成或抗血管生成潜力是什么?
2.哪些基因和通路参与血管生成?
3.抑制剂或增强剂对管形成有何影响?
4.血管生成过程中信号如何转导?
5.血管生成过程中的细胞骨架效应是什么?
6.哪些细胞是内皮祖细胞?
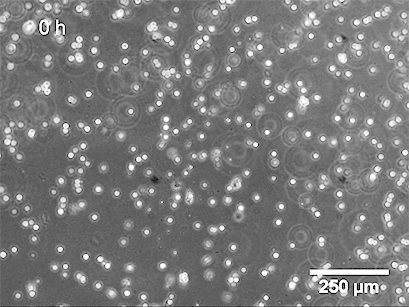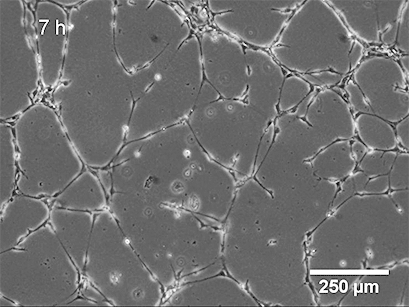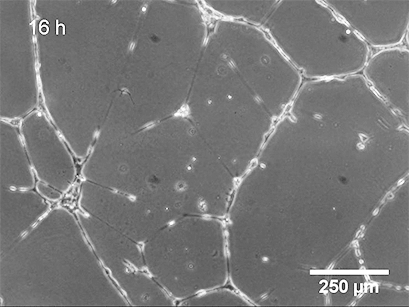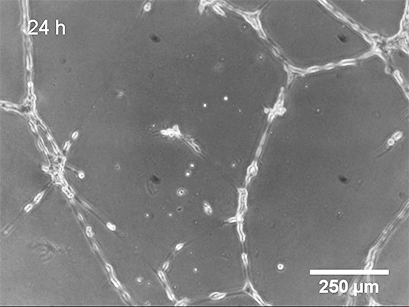
使用 ibidi Stage Top Incubation System 的活细胞成像 显示了管形成试验中 HUVEC 的管形成。
基底膜表面及其成分是管形成试验成功的关键。可以应用不同类型的基底膜(例如,Matrigel ®、胶原蛋白或其他水凝胶基质),这会导致不同的管形成率。内皮细胞在形态上分化形成管。细胞首先附着在基质上并相互迁移。然后,它们附着在其他细胞上,对齐并形成毛细管状管。管子成熟直到细胞最终经历细胞凋亡,导致从表面脱离和管子破坏。
管形成试验是通过首先接种单个细胞,然后随着时间的推移观察和成像管形成来进行的。随着时间的推移,可以对几个读数进行成像和分析,例如管长度和循环数。通常,管子在几个小时内形成,使管子形成分析成为胚胎发育、癌症、伤口愈合和组织修复研究领域中血管生成定量的快速工具。
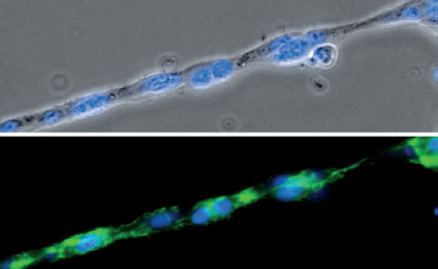
在µ-Slide 血管生成中的管形成测定期间,由 HUVEC 细胞组成的单链的相差(上图)和荧光观察(下图)。F-肌动蛋白细胞骨架被染成绿色,细胞核被染成蓝色。
# 发芽试验 #
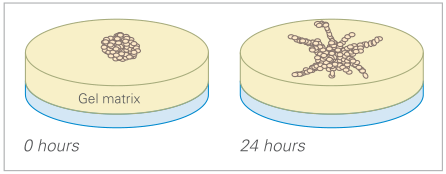
类似于管形成试验,发芽试验也可用于量化体外血管生成。
在这里,多细胞球体或组织块(例如,来自主动脉)被置于凝胶基质(例如,Matrigel ®、胶原蛋白)中或之上,然后它们在那里形成芽。
为了进行分析,在定义的时间点对细胞簇的发芽进行成像,并测量发芽长度。发芽试验与管形成试验一样,需要明确定义的凝胶层厚度,这在使用µ-Slide Angiogenesis和 µ-Plate Angiogenesis 96 Well时是标准化的 。
# 血管新生和血管生成 #
开始实验之前需要回答以下问题:
1、哪种细胞密度最适合我的实验?
确定正确的细胞数量对于从管形成试验中获得最佳结果至关重要。细胞密度取决于细胞类型和细胞大小。在开始实际实验之前,我们建议在非抑制条件下接种几个细胞数并对管形成进行成像。创建的管数最多的细胞密度将显示出最明显的物质效应,因此应用于实验。请记住,细胞通常不会在凝胶基质上增殖。通常,我们建议每孔使用 5,000–10,000 个 HUVEC。
2、我应该使用哪种凝胶基质?
内皮细胞的管形成率取决于形成基底膜样细胞外基质 (ECM) 表面的凝胶的类型和成分,细胞在该表面上接种。几种基底膜提取物可获得,例如 Matrigel® 和 Cultrex®.,两者均由 Engelbreth-Holm-Swarm (EHS) 鼠肉瘤细胞分泌。在开始使用特定内皮细胞类型进行实验之前,我们建议测试几种基底膜物质并遵循已发布的说明。如果将在您的分析中测试促血管生成剂,则应使用减少生长因子的凝胶基质。此外,如果可能,在整个实验中使用相同的批次。
3、实验中应包括哪些对照?
为了对您的结果进行正确的统计分析,包括阳性和阴性对照非常重要。作为阳性对照,在不使用任何抑制剂的情况下对您感兴趣的细胞系进行管形成试验。当在含有饥饿培养基的生长因子减少的 Matrigel® 上培养时,内皮细胞应在几小时内显示出管的形成。作为阴性对照,可以使用不影响细胞活力的管形成抑制剂。
4、我的移液器工作准确吗?它们是否经常校准?
为避免在使用 µ-Slide 血管生成时凝胶基质形成弯液面,将准确数量的 10 µl 移入内孔至关重要。此外,接种正确的细胞数非常重要。因此,有必要使用处于完美工作状态的校准移液器。我们建议用相应的凝胶润湿移液器吸头,然后使用这个吸头填充孔。
5、我应该在哪个时间段内观察细胞?
管形成的持续时间取决于细胞类型和所使用的细胞外基质,应单独确定。通常,HUVEC 在 2-4 小时后已经形成管。24 小时后,细胞开始发生凋亡,这会导致从基质上脱离和管子破裂。
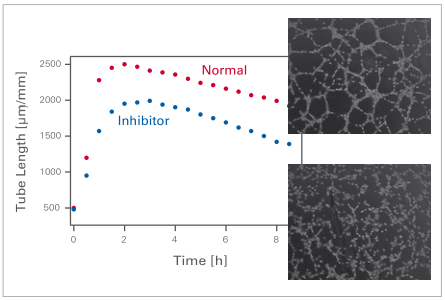
6、我应该手动还是自动监测管子的形成?
如果有活细胞成像设备,我们建议使用延时视频成像——尤其是当您不熟悉所用细胞类型的血管生成行为时。在典型的设置中,在 24 小时的时间范围内每 5-15 分钟自动拍摄一张照片。这使得能够精确监控管形成的进程,例如,在添加特殊物质之后。如果您已经知道管形成的大致时间范围,也可以在预期的感兴趣时间点手动拍照。
#ibidi血管生成载玻片原理 #
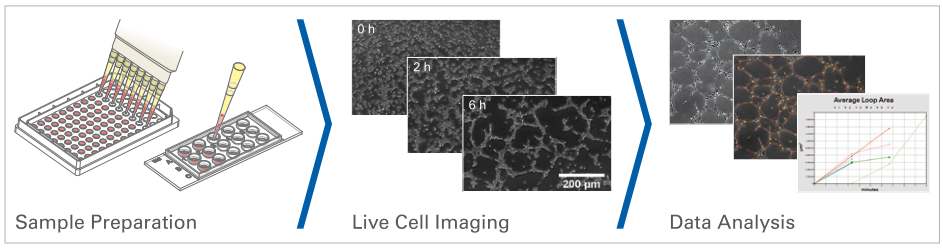
1、样品制备
使用 µ-Slide 血管生成时,由于采用孔中嵌孔技术,凝胶基质的量减少到每孔 10 µl。
将凝胶基质(例如 Matrigel ®、胶原凝胶或水凝胶)移入 µ-Slide 血管生成的下部孔中。培养直到凝胶聚合,然后将细胞接种到上孔中。接种后不久,细胞会下沉到凝胶表面,然后就可以进行观察了。
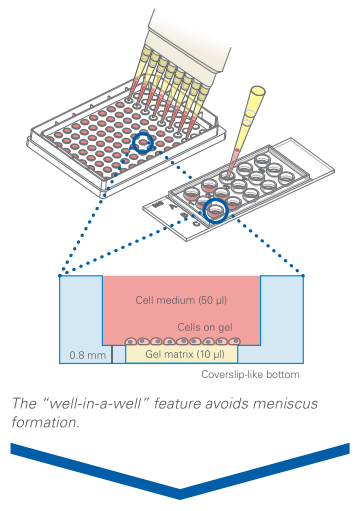
2、活细胞成像
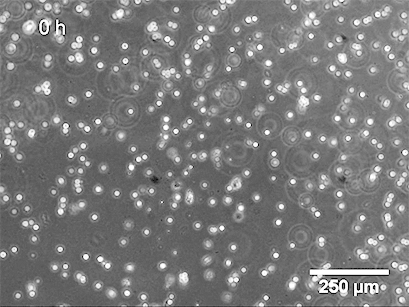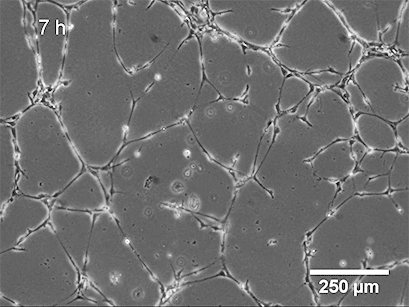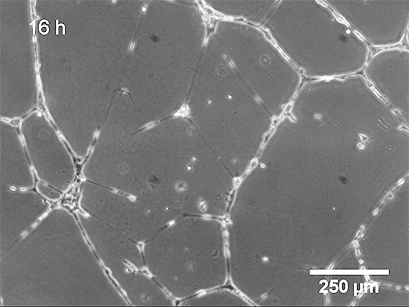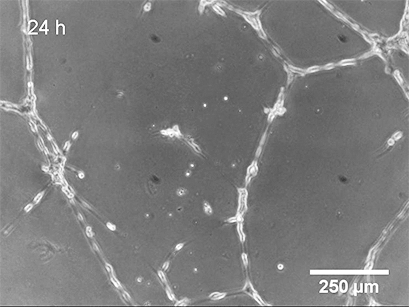
3、数据分析
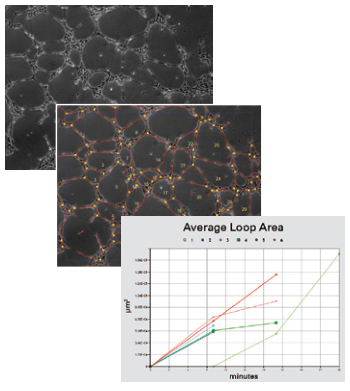
图像采集后,可分析管面积、管长、管数、环面积、环数、芽数等参数。这可以手动执行,也可以使用自动化软件执行。参数的统计比较(单独或组合)将概述不同条件下管形成的程度。
ICP备案号:
沪ICP备15057650号-1
 沪公网安备31011202005471
雷萌生物科技(上海)有限公司 保留所有版权.
沪公网安备31011202005471
雷萌生物科技(上海)有限公司 保留所有版权.