date:2022-02-16 10:34:13
不同细胞类型的细胞接种密度特征(见第 4.1.2 节)
1.介绍
血管生成实验是筛选物质以发现它们对培养细胞的抗或促血管生成作用的有力工具。通过比较用物质处理的细胞与对照细胞培养物,物质的效果可以通过管长和凝胶(即 MatrigelTM值)表面形成的环数等参数来衡量。
进行血管生成分析需要优化实验方案并建立提供可靠数据采集方法。实验设置的三个关键组成部分是数据采集时间点、细胞接种密度和细胞培养基的血清浓度。
本应用将帮助使用您自己的细胞系优化试管形成分析的实验设置,确保可靠的数据采集和可重现的结果。
在本应用简报的某些部分,我们讨论了ibidi µ-Slide 血管生成,但在任何容器中进行的管形成分析都将显示相同的特征,并且可以以相同的方式处理数据。

µ-Slide 血管生成载玻片
2.选择正确实验方案
进行血管形成分析的第一步是确定实验方案。三个最重要的考虑因素是:
· 细胞类型——内皮细胞中生理性地观察到管形成
· 凝胶基质——它需要与细胞相容,并且必须为细胞附着提供结合基序
· 培养基成分(要求生长因子?)
适用于大多数内皮细胞的设置包括MatrigelTM、减少生长因子和含 2% 或更少血清的内皮细胞培养基。
3.数据分析概述
为了更好地理解优化的后续步骤,需要对数据分析参数进行概述。
如下图所示的显微图像显示了具有四个可检测关键参数管状网络:
· 细胞覆盖区域(蓝色)
· 管(红色)
· 循环(黄色)
· 分支点(白色)
可以从这些参数计算其他值,例如平均管长度、总管长度和平均环路面积。
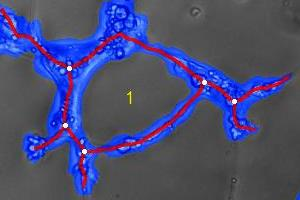
图1,管形成分析的关键指标
有几种方法可以执行图像分析。一种方法是使用图像处理软件手动执行此操作,例如 ImageJ“血管生成分析器”。
另一种选择是使用自动图像分析平台,例如ACAS.
4.实验前工作
在开始筛选实验之前,必要优化实验程序和设置。
4.1. 实验装置的优化
细胞接种密度、数据采集时间点和血清浓度对数据值有很大影响。因此,创建严格对于生成可重复的数据和数据集之间的可比性至关重要。
4.1.1. 测量时间间隔
首先,选择细胞浓度和促进血管形成的设置来记录时间曲线。对于人脐静脉内皮细胞 (HUVEC) 每孔约 10,000 个细胞,使用具有减少生长因子的基质胶TM值和不含血清或生长因子的细胞培养基就足够了。
接下来,按照应用说明制备凝胶和细胞悬液,“ibidi µ-Slide 血管生成的形成分析”。在凝胶表面播种细胞后,立即将载玻片放入显微镜的培养室中,并开始延时记录。每 10 分钟记录一张图像,使用基于软件的工具在每个时间点调整焦点。或者,如果您的显微镜上没有孵化室,则每小时记录一次图像,至少在前 8 - 10 小时内。记录每个图像后立即将样品放入细胞培养箱中。在过夜培养后记录最终图像。
最后,分析图像并使用合适的软件可视化曲线。参数(例如,总管长)的时间曲线通常如下图所示。曲线上升到最大值(约 5 小时),然后下降到平均期(约 7 小时开始),然后慢慢变平(> 20 小时)。由于所有四个关键参数的特征看起来相似,只评估一个参数就足够了。我们选择管总长度作为参数,因为原始图像提供了一个控制,可以轻松地与评估图像进行比较。
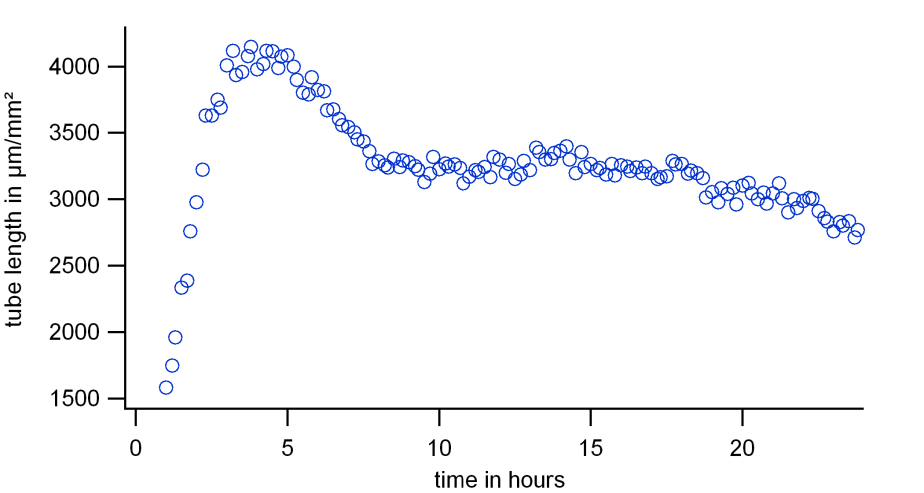
图2,24小时内管长的时间响应
最佳结果出现在最大阶段以及不会迅速下降的稳定阶段。在上例中,4 小时时间点和 10 小时时间点是很好的测量参考点。
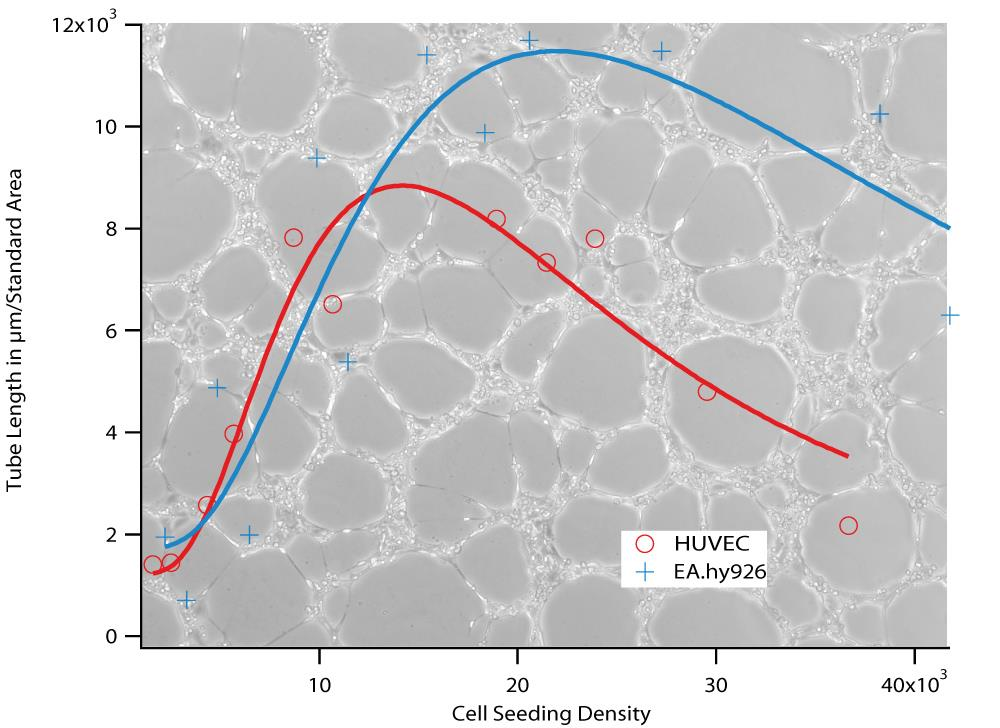
4.1.2. 细胞接种密度
要确定最佳细胞接种密度,请记录细胞系的特征。
首先,在 5-40 x 10 3cells/ml 范围内进行一系列稀释,然后将细胞接种到凝胶表面。按照第 4.1.1 节中的说明将样品孵育确定的时间长度,并记录相衬图像。每个细胞浓度执行五次重复。
评估图像,分别在第 3 节和第 5 节中提到。将数据可视化为图表,如下所示。数据将显示具有最大值的特性曲线。该最大值是您的细胞类型的最佳接种密度。
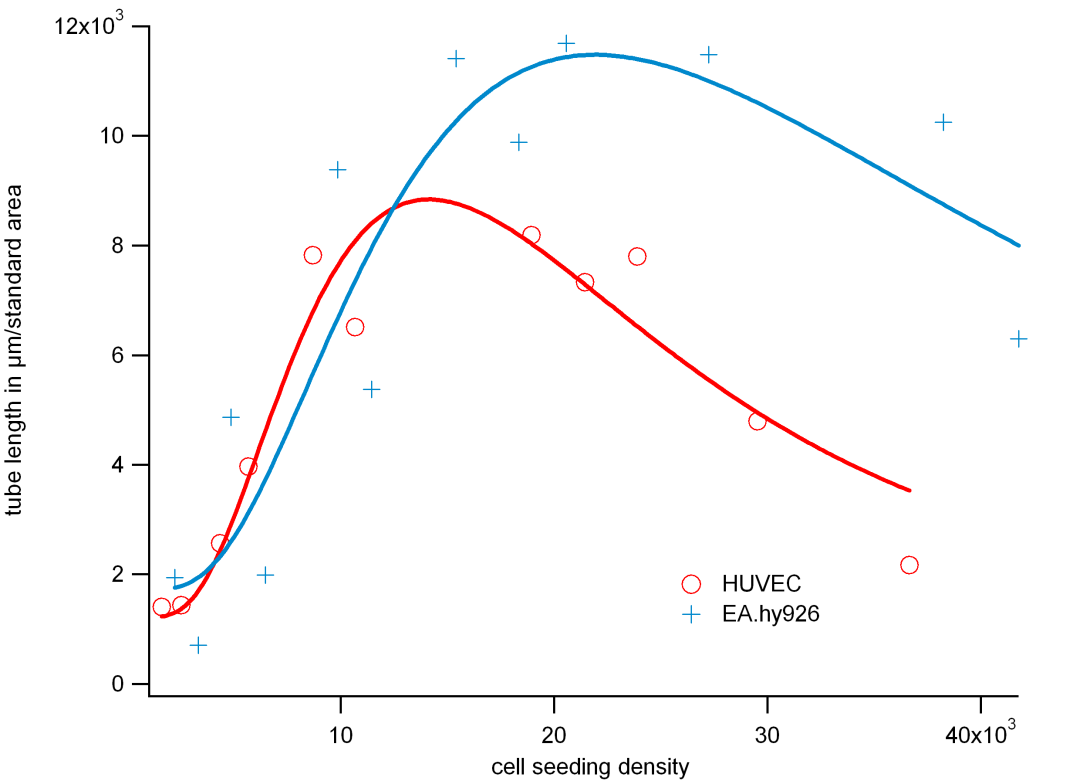
图3,HUVEC 和 EA.hy926接种4小时后的密度响应
4.1.3. 血清浓度
向培养基中添加血清可能会影响试管形成行为。在大多数情况下,血清抑制管形成。为避免此问题,请使用您在第 4.1.1 节和第 4.1.2 节中确定的条件测试不同的血清浓度,范围为 0 - 20%。这将确定哪种血清浓度最适合血管生成和细胞存活。
4.1.4. 放大倍数
放大倍数决定了能够被相机成像的孔区域。由于管的形成发生在孔的整个表面区域,重要的是尽可能地对最宽的部分进行成像。如果不需要检测细胞内细节,请使用低倍率(4 倍或 5 倍)。如果需要检测细胞内细节,建议对每个孔拍摄几张放大倍数更高的图像并将它们拼接在一起
4.2. 建立阳性和阴性对照
要创建阳性对照,请选择确保血管形成的实验系统(例如,具有减少生长因子的基质胶TM值和用于 HUVEC 的无血清培养基)。阳性对照确保细胞是健康的,并且观察到的任何抗血管生成作用都是由所研究的物质引起的。
要创建阴性对照,请选择一种经证实对血管形成发展具有抑制作用的物质(例如,用于 HUVEC 的苏拉胺)。阴性对照确保可以抑制细胞中的管形成,并为您的实验结果提供一个比较点。
4.3. 实验计划和重复次数
在进行实验之前,计算所需材料的数量,例如细胞、培养基、凝胶基质和物质。还要计算实验室设备和空间要求以及时间表。
为了正确地进行统计分析,建议至少进行四次独立实验,每个实验至少有 8 个单孔。所需的实验次数取决于数据的均匀性。遵循严格的协议对于数据采集至关重要。
对数据集执行学生 T 检验。p 值 ≤ 0.05* (≤ 0.01**) 表示该模型有足够的功效,无需额外实验即可继续。
4.4. 文档
合理的文档包括本节中确定的所有参数。生成一个表格图表,其中每个实验都记录在一列中。附录中给出了一个例子。
5.数据分析
每个分析孔生成一个管长度值。然后将一个实验(每个条件至少 8 个孔)的值相加并计算标准偏差。标准偏差应小于 10%。这只是一个实验数据点。
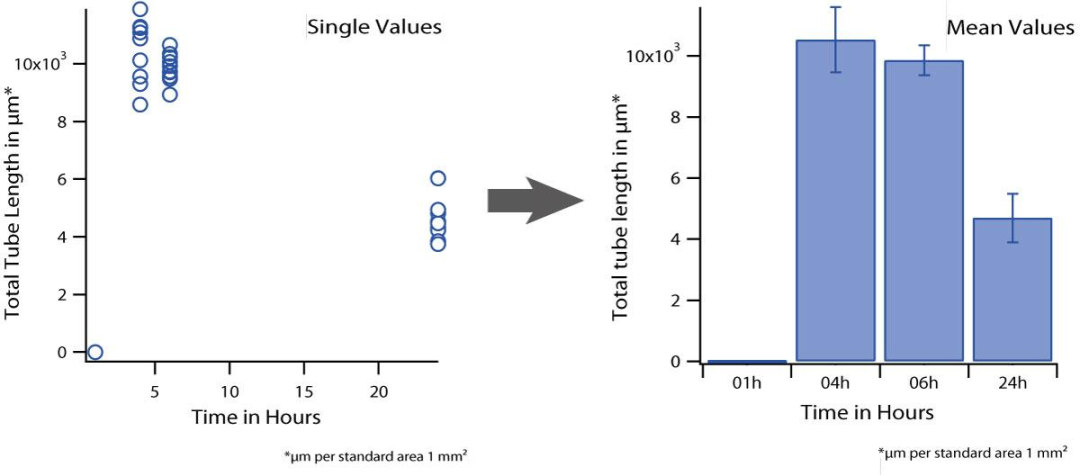
左图显示了在四个不同时间点,一种实验条件下单孔结果的分布。右图显示了一种实验条件在四个不同时间点的平均结果。
为了正确稳定的统计分析,每个条件至少需要四个数据点。请记住,每个数据点由 8 个单独的孔组成。
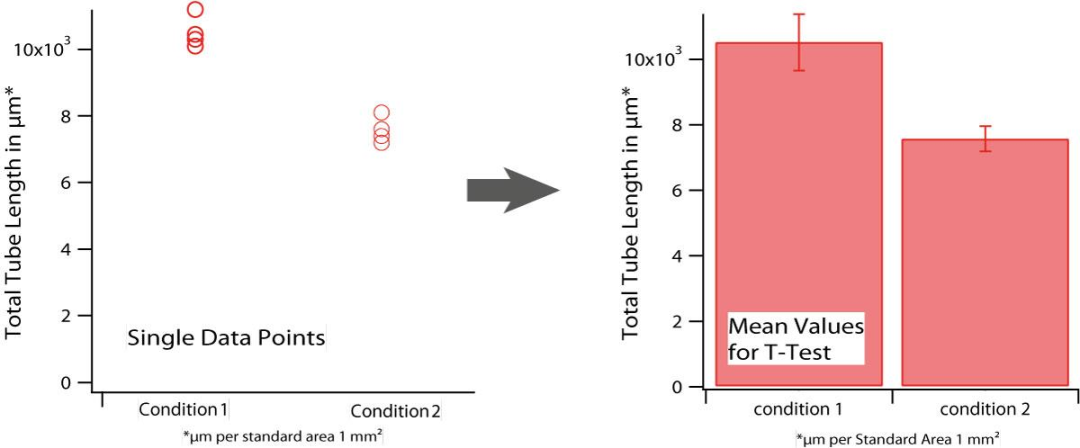
单个数据点合并为一个平均值,并可以显示在条形图中。统计分析是通过学生 T 检验完成的,其中对不同的数据点群体进行相互检验。
6.数据解读
学生的 T 检验提供了两个单独的数据集是否具有 t 分布值的证据,表明彼此之间存在统计学上的显着差异。实验中的重复次数和实验次数会影响分析。学生 T 检验可以使用统计分析软件(即 SAS)或 Microsoft® Excel® 进行。
重要的是要考虑可以使用管形成数据实际预测的内容。管的形成是一个非常复杂的过程,它结合了各种各样的生化反应和途径。我们认为,该实验装置适用于筛选物质并提供有关物质抗促血管生成作用的初步预测。它没有解释任何观察到的效果是如何工作的。需要额外的生化分析来确定这一点。
ICP备案号:
沪ICP备15057650号-1
 沪公网安备31011202005471
沪公网安备31011202005471
雷萌生物科技(上海)有限公司 保留所有版权.