细胞成团和细胞出芽实验
导言:近几年来,3D(three dimensional)细胞培养系统开始成为生物学研究新的研究方法。使用3D系统培养系统能更好的模拟生物体内的真实生理环境,而2D(传统的贴壁培养)细胞培养系统不能有效的模拟细胞在生物体内的生理环境。3D细胞技术有很多种方法,使用多细胞形成的细胞团是其中主要的研究应用之一。细胞团是微小的细胞聚集簇,可以用来研究3D情况下向外生长的情况(细胞出芽)。
一.实验原理
目前有几种方法可以用来生成细胞团。 所有方法的原理都是防止细胞贴壁,并且创造环境增强临近细胞间的细胞外基质的粘附。这里我们提供的是一个液体胶的形式来形成细胞团。这是一种形成细胞团的非常简单的方法,有如下的优势:
1)可以形成单个细胞团,并且易于用显微镜观测;
2)易于换液,可以进行长时间的培养;
3)这个方法操作简单,不需要额外的设备就能完成。
简单来讲就是先在多孔板底部加入琼脂糖,之后再加入细胞悬液。加入琼脂糖不仅仅是提供了个疏水表面,细胞不会粘附,又提供了一个凹液面,细胞可以聚集在凹孔中,加大了细胞和细胞之间接触的几率,增强了细胞之间的粘附。
二.实验材料
96孔板,平底(Corning 3370)
血管生成载玻片(德国ibidi,81506)
1.5%琼脂糖(Sigma,A9539,使用PBS或者超纯水配置)
胰酶
Matrigel
细胞培养基
三.成团实验步骤
1)96孔板预处理
● 配置1.5%琼脂糖,保持配好的琼脂糖为液体状态
● 96孔板每孔添加50μl配置好的1.5%琼脂糖,室温静置20分钟,待琼脂糖完全冷却固化。50μl琼脂糖能刚好覆盖96孔板单孔的底部,并且形成凹液面。
● 在96孔板的孔间加入无菌PBS,保证实验的湿度
1.细胞成团
● 按照日常方法准备细胞悬液
● 根据试验设计确定单孔需加入的细胞个数,本例中,每孔加入500个细胞
● 加入50-100μl的稀释好的细胞悬液,保证每孔总液体体积(包括琼脂糖)不超过200μl,每孔细胞数500个
● 培养箱中培养
● 每天都要换液,注意在细胞成团过程中不能剧烈晃动培养板
● 可以用相差显微镜观察细胞成团情况(图一)。
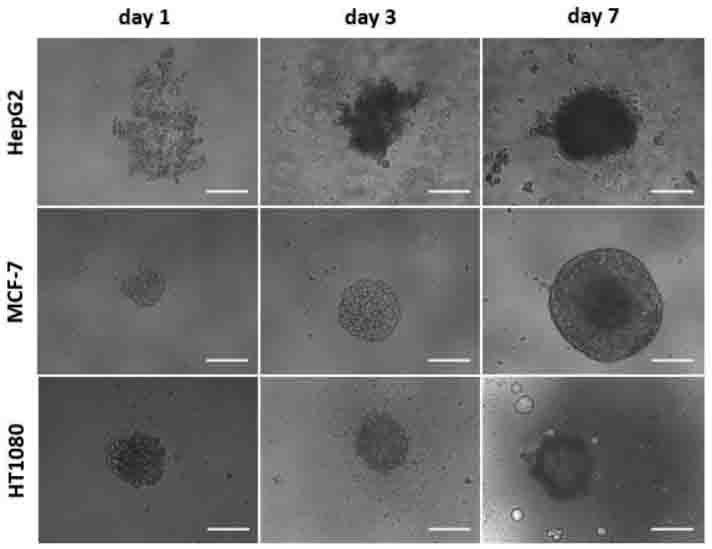
图一:不同细胞系的成团过程(每孔500个细胞),比例尺 200μm。
一.出芽实验及分析
实验步骤:
1.准备基质胶
● 实验前一天将Matrigel置于冰盒中,放入4。C冰箱,使胶能过夜缓慢融化。(注意:同样要准备一些4。C预冷的枪头用于吸取Matrigel)
● 开始实验前,将Matrigel始终保持放在冰盒中。
● 打开灭菌包装,取出ibidi血光生成载玻片 µ-Slide Angiogenesis。
● 每孔中加入10μl Matrigel。注意枪头要垂直于内孔的正上方加入Matrigel,防止有Matrigel流经上孔而留下残留胶。
2.凝胶
● 盖上ibidi血管生成载玻片的盖子。
● 准备一个10cm的培养皿,放入浸过水的纸巾,制成一个湿盒。
● 将ibidi血管生成载玻片放入培养皿中,盖上培养皿盖。
● 将整个培养皿放入培养箱中,静置30分钟左右,等待胶凝结。
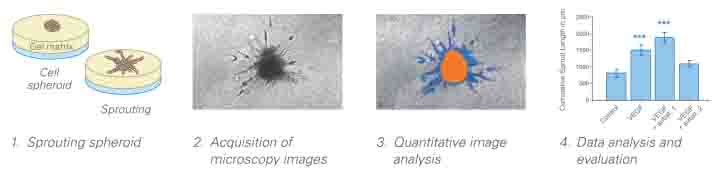
3.细胞出芽实验及图像分析
● 将形成的细胞团吸出,置于凝固的胶平面上
● 培养并使用显微镜采集出芽图像
● 采用图像分析软件采集细胞团面积,出芽覆盖面积,出芽个数以及总出芽长度等数据。




 沪公网安备31011202005471
沪公网安备31011202005471