探讨流体剪切力对细胞活动的影响--流体剪切力对细胞吸收人造细胞器的影响
丹麦奥胡斯大学的纳米科学中心近日在SMALL杂志上发表了一篇关于纳米材料作为有细胞活性人造细胞器的文章。文章介绍了个有趣的现象:细胞在剪切力条件下培养的时候,会吸收更多的纳米颗粒,并且没有附加的细胞毒性。
文章中采用了内皮细胞和巨噬细胞做为实验细胞。将细胞培养在ibidi通道载玻片中,之后使用含有纳米颗粒的培养基,以一定的剪切力刺激细胞,细胞吸收的纳米颗粒的量比静置状态下有显著的升高。
分享一下这个实验的细节,或许大家可以从中找到自己研究领域的灵感。
一、实验准备实验材料及设备
1.细胞: 内皮细胞、巨噬细胞
2.纳米颗粒:pPDA:在800nm直径的二氧化硅表面包被多聚多巴胺(dopamine)
pPEG:在800nm直径的二氧化硅表面包被多聚乙二醇(ethylene glycol)
pRGD:在800nm直径的二氧化硅表面包被L-精氨酸、甘氨酸和L-天门冬氨酸的多聚物(Arginylglycylaspartic acid ( RGD ) is a tripeptide composed of L -arginine , glycine , and L -aspartic acid)
3.培养耗材:ibidi六通道载玻片μ-Slide VI0.4 Luer (ibidi,Germany,80606)
灌流管,15cm,1.6mm直径(ibidi,Germany,10962)
串联管(ibidi,Germany,10830)
封口夹
1.仪器设备:ibidi流体剪切力系统,含空气泵(ibidi,Germany,10905)和流体单元(ibidi,Germany,10903)
一.实验方法
在实验开始前一天,请将所有需要使用的试剂,培养基,通道载玻片,灌流管都在37℃的二氧化碳培养箱中放置过夜,排除由于温度差产生的微量气泡。
一)培养细胞
准备内皮细胞和巨噬细胞,按照常规细胞培养方法进行培养。尽量使用比较健康的内皮细胞,以防在做流体实验时候细胞不能稳定贴壁。
按照下面流程铺细胞:
1.按每通道10000个巨噬细胞和40000个内皮细胞将细胞铺于通道载玻片的中,注意,将移液器头插入注液孔中再加入细胞悬液,可以轻微倾斜通道载玻片帮助细胞悬液充满整个通道。
2.盖上注液孔盖,将通道载玻片放入细胞培养箱中培养半小时,等待细胞贴壁。细胞贴壁后,拿出通道载玻片,在每个注液孔中分别加入60μl培养基,注意,枪头要悬在孔上方滴入培养基。
3.将通道载玻片再放入二氧化碳培养箱进行培养2-4小时左右,等到细胞刚刚长满为单细胞层,即可开始实验。注意,要使用单层细胞进行剪切力实验,使每个细胞均受到均匀的剪切力。
一.搭建流体系统
1.将灌流管按照说明放在置在流体单元上。在灌流管的储液管中加入含纳米颗粒的7.5ml培养基。这时不需要连接通道载玻片。实验前需要去除整个灌流管中的气泡,存留在灌流系统的气泡会影响剪切力的大小,有时还会使灌流系统中的液体流动停滞。打开ibidi泵控制系统,在任务栏中找到“Remove air bubbles”,ibidi流体剪切力系统将自动运行下面任务,用于去除气泡。(表一)
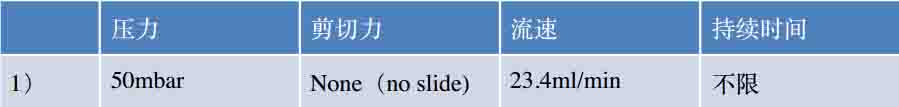
2.连接通道载玻片。使用串联管,将通道串联起来。这样可以在同一个条件,同一种液体的刺激下培养不同的样本。

在细胞贴壁后,将串联管如如图示插入串联管

在每一个注液孔中加满培养基,要注意不能把气泡加入在注液孔中。

用1ml的无菌注射器吸满培养基,小心插入如图的孔中,不要引入气泡。
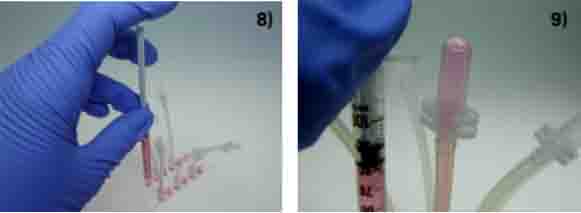
小心推入培养基,直到第一个串联管有培养基微微冒出。
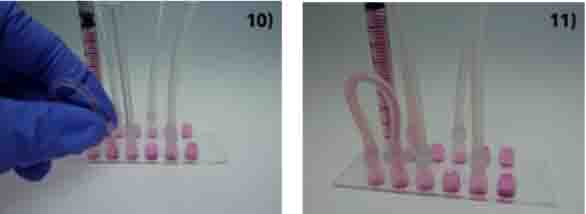
小心的将串联管弯过来,插入相邻的注液孔中。不要产生气泡。
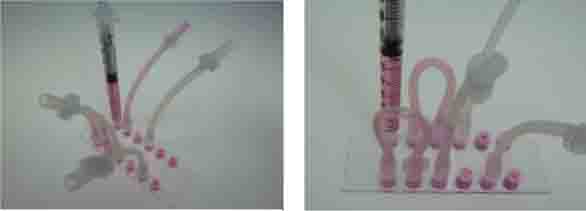
继续推动注射器,直到第二根串联管也被充满,继续推动注射器充满下一根串联管。
重复上面的操作,继续充满所有的通道和串联管。

将所有的串联管连接好后,将加满液体排除气泡的灌流管用封口夹夹住。
小心将灌流管的一个鲁尔接头从联通管中拔出,插入末尾一个注液孔中。

小心将注射器移除,在注液孔中加满培养基,将灌流管的另一个接头插入。

串联灌流系统搭建完成。
三 实验结果
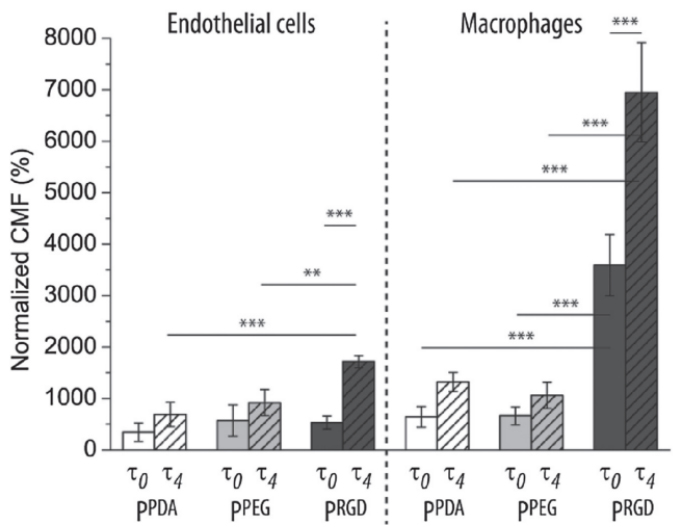
如图所示,对于内皮细胞和巨噬细胞,在剪切力为г4=4 dyn/cm2时比静置条件г0吸收pRGD这种纳米材料有非常显著的升高。














 沪公网安备31011202005471
沪公网安备31011202005471