细胞趋化实验新方法(二)--实时观察细胞动态
案例:细胞作为趋化因子
上篇ibidi细胞趋化应用中(见链接: )以Dendritic cell对CCL19细胞趋化反应为例介绍了细胞趋化的新方法。
本案例将介绍如何用细胞作为细胞运动的化学趋化因子。
如图所示:观测通道中可以使用贴壁细胞,或者是3D培养的细胞。用于趋化的细胞可以直接注入其中一个储液池中(图一)。
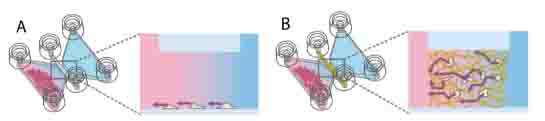
图一:A待观察细胞为贴壁细胞,受到左边的储液池中细胞影响具有了趋化行为。B待观察细胞为3D培养细胞,在基质胶中同样也受到了储液池中的细胞的影响具有趋化行为。
一、实验材料准备:
1.仪器:
● 细胞培养箱(高湿度,37℃,5%CO2)
● 倒置显微镜,具有10X相差物镜和定时拍照功能
● 镜载加热孵育系统(37℃,5%CO2)
● 可选配置:全自动载物台,自动对焦系统
● 分析软件:可选用手动分析软ImageJ的“Manual Tracking”模块,或全自动的ibidi提供的WimTaxis进行细胞轨迹追踪。使用ibidi公司的“Chemotaxis and Migration Tool” 进行数据统计分析。
1.实验材料准备:
实验前一天准备工作:
为了减少ibidi细胞趋化载玻片与培养基中的气泡,将载玻片和培养基提前24小时放入培养箱中

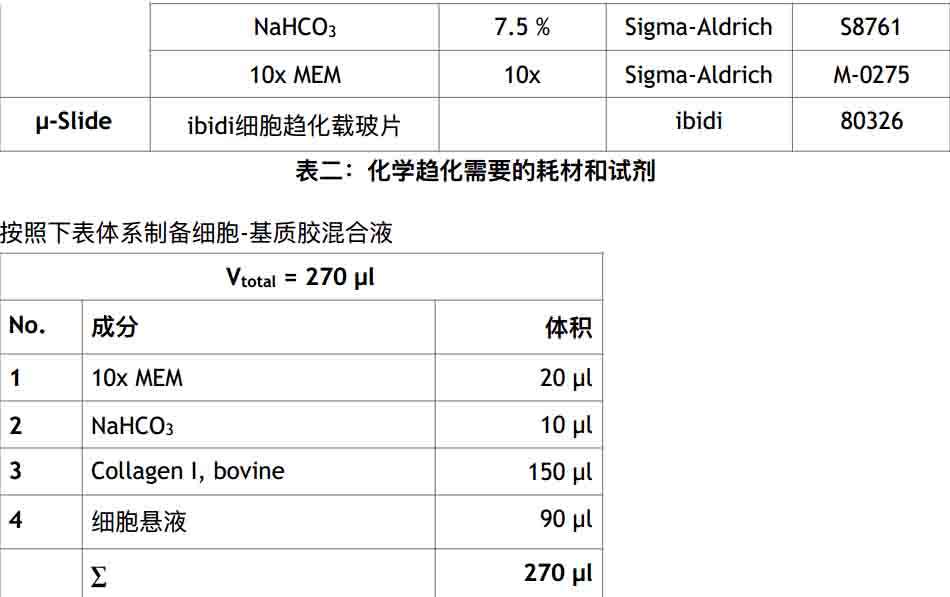
表三:制备1.6mg/ml 基质胶
操作步骤:
● 使用表一中的培养基制备 9 x 106 cells/ml 的细胞悬液
● 在1.5ml离心管中小心混匀表三中的1和2号试剂,避免产生气泡
● 在另一1.5ml离心管中准备150 μl collagen I
● 使用200μl枪头从第二步的混合液中吸取30μl(图一A)
● 小心混匀(图一B),避免产生气泡
● 加入90μl细胞悬液到上一步混合液中(图一C)
● 小心混匀(图一D),避免产生气泡
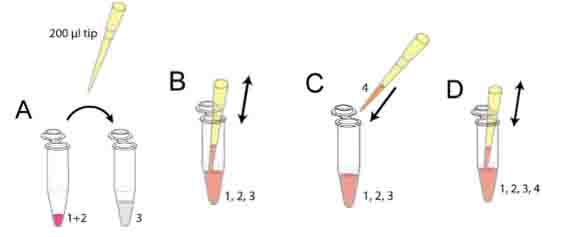
图一:制备细胞-基质胶混合液图示,注意:1)避免产生气泡,气泡会破坏胶原纤维,不能使用Vortex;2)胶原混合后,离胶凝大约有5分钟时间,如果在凝胶后再进行操作会破坏胶原纤维;3)当刚加10x MEM到NaHCO3中的时候会看到颜色变化,这表明没有充分反应,因此加入混合液到胶原蛋白中后要充分混匀。
一.细胞趋化实验
1.趋化试剂
● 细胞趋化物:作为趋化因子的细胞 1-5 x 105 cells/ml
● 培养基:建议使用同一种培养基,并且需要优化一下血清浓度,建议使用低浓度的血清,减少由于血清造成的生长因子而减弱了趋化造成的影响。
1.实验步骤
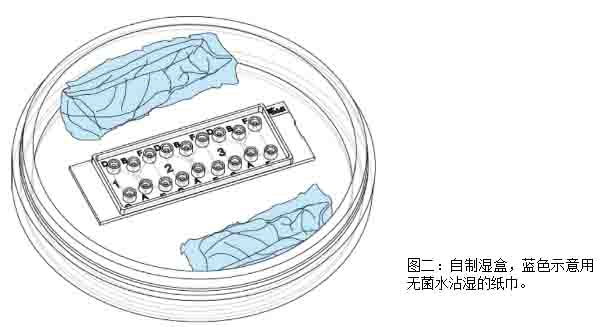
开始细胞实验之前,要准备一个湿盒将细胞趋化载玻片放在湿盒中。可以用一个放了浸湿的纸巾的10cm培养皿作为湿盒(如图二)。
贴壁细胞准备:
● 如图,用小塞子将C、D、E、F塞紧。使用20μl的枪头从A中加入6μl细胞悬液。并使用同一个枪头立即从B孔向外吸。直到观测通道被细胞悬液充满。
● 在注液孔中加入培养基到图示位置(图三(B))。移走所有小塞子。将载玻片放在培养箱中等待细胞贴壁。
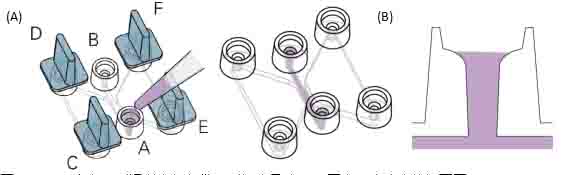
图三:(A)示意向观测通道中加入带观测细胞悬液。(B)图表示注液孔的切面图。
● 1-5小时后,用显微镜检查细胞是否完全贴壁,如果完全贴壁,需要更换培养基。用小塞子将C、D、E、F塞紧。从A中加入10μl新鲜培养基。注意不要加入气泡。同样用同一个枪头从B向外吸。
● 重复三次。
● 在注液孔中加入培养基到图示位置(图三(B))。移走所有小塞子,将A、B孔塞紧,准备开始趋化实验。
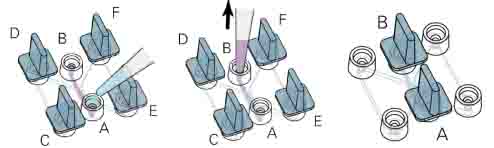
图四:细胞贴壁后用无细胞培养基更换观测通道中的培养基。
3D细胞准备
● 如图,用小塞子将C、D、E、F塞紧。使用20μl的枪头从A中加入6μl细胞-基质胶混合液。并使用同一个枪头立即从B孔向外吸。直到观测通道被细胞-基质胶混合液充满。
● 在注液孔中加入基质胶到图示位置(图五(C))。移走所有小塞子。小心将A、B孔塞紧,将载玻片放在培养箱中30-35分钟,等待胶凝固后开始趋化实验。
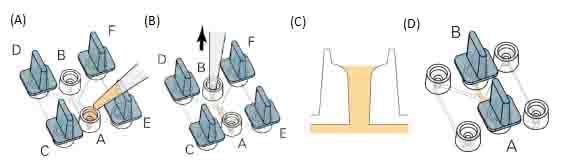
图五:(A)向观测通道加入细胞-基质胶混合液。(B)用同一个枪头从另一个孔中向外细。(C)注液孔切面图。(D)将A、B口塞紧,开始趋化实验。
加入趋化细胞:
● 细胞贴壁或胶凝固后,将C、D两个孔用塞子塞紧。从E中加入65μl新鲜培养基,充满整个储液池。(图六)
● 再小心移除C、D两孔的塞子。把E、F两孔塞紧,同样的操作从C加入65μl培养基。
● 用20μl枪头从C中加入15μl作为趋化因子的细胞悬液,用同一个枪头从D中吸出15μl。
● 重复上步操作,加入总量30μl的细胞悬液。
● 将所有孔塞紧,静置30分钟后,就可以进行图像采集。
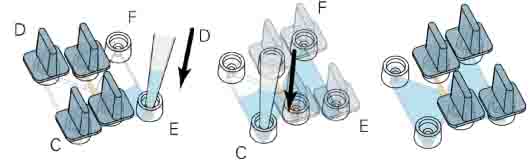

图六:加入作为趋化因子的细胞。需先用无细胞的培养基将储液池充满,再逐渐加入细胞,加入后将所有塞子塞紧静置一会,再开始实验。
● 对照,在两边储液池中均加入60μl的无化学趋化物培养基作为空白对照(-/-),和两个储液池均加入30μl细胞悬液作为阳性对照(+/+)。
● 按说明,将通道加液孔塞紧后可以进行图像采集。
● 将载玻片置入镜载加热孵育系统中,调整好采集位点,开始录制实验结果。
三、图像处理
1.手动细胞轨迹追踪
● 下载ImageJ,并安装Manual Tracking模块
● 导入采集的系列图像到ImageJ中,打开模块“Manual Tracking”,选择“Add track”开始记录细胞轨迹
● 选择一个细胞,按照时间点单击细胞,第一点击后,会有新窗口跳出来显示初始位置,以后每次点击,都将在这个新窗口中产生一个该细胞随着时间的新坐标
● 统计完足够的细胞轨迹后,保存轨迹坐标表格
● 至少收集30个细胞的轨迹才具有统计学意义,避免同一细胞追踪两次,去除由于凋亡会而不能采集完整的轨迹的细胞
● 可以将“Overlay dots & lines”以.avi格式导出
2)全自动细胞轨迹追踪
使用ibidi的WimTaxis自动分析平台,将采集的系列图像上传到该平台,几个工作日后,会得到细胞轨迹的坐标表格数据结果。
四、数据处理
使用迁移指数( Forward Migration Indices*,FMIs)作为比较趋化实验和对照试验的参数。在有趋化物的情况下,空白对照的FMI和与趋化物垂直方向的化学趋化的迁移指数(FMI┴)应是在0点左右。而与趋化物平行方向的化学趋化的迁移指数(FMI‖)与0点有显著的区别表现出了化学趋向性。同时,使用Rayleigh Test**对细胞趋化的方向性进行检验。如果p值大于0.05表示了细胞运动的无序性,表明没有方向性的迁移。此外,迁移速率等参数也能直接用于分析。
*Foxman et al. Integrating conflicting chemotactic signals. The role of memory in leukocyte navigation, J Cell Biol 147, 577-588 (1999)
**Fisher, N. I. Statistical Analysis of Circular Data, Cambridge University Press, New York (1993)











 沪公网安备31011202005471
沪公网安备31011202005471